高三化学基础测试
一、选择题(共15小题,每小题4分,共60分)
1.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.酒精溶于水 D.HCl气体溶于水
2.美国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家认为世界上还存在着另一种“分子足球”—N60 ,具有相似的结构,并且在高温或机械撞击后,其积蓄的巨大能量会在一瞬间释放出来。对于N60 ,下列说法中正确的是
A. N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素
C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来有可能会成为有发展前途的高能燃料
3.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A. SiO2和SO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和HCl
4.下列说法中正确的是
A. 冰熔化时,分子中H—O键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔沸点一定高
D.分子晶体中,分子间作用力越大,该物质越稳定
5.下列叙述正确的是
A. 同主族元素的原子半径越大,熔点越高
B.稀有气体原子序数越大,沸点越高
C.分子间作用力越弱,分子晶体的熔点越低
D.同周期元素的原子半径越小越易失电子
6.氯化铯晶胞(晶体中重复的结构单元)如下图(1)所示,该晶体中Cs+与Cl-的个数比为1∶1,化学式为CsCl。若某晶体晶胞结构简式如图(2),其中含有A、B、C三种元素的的微粒,则该晶体中A、B、C的微粒个数比为
A. 8∶6∶1 B.4∶3∶1 C.1∶6∶1 D.1∶3∶1
 |  | ||
![]()
![]()
![]()
![]()
![]() Cs
Cl
A B C
Cs
Cl
A B C
7.熔点比正丁烷低的物质是
A. 金刚石 B.食盐 C.CH3(CH2)4CH3 D.(CH3)2CHCH3
8.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合。据右图分析,石墨晶体中碳原子数与共价键之比为
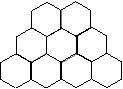
A. 2∶3 B.2∶1 C.1∶3 D.3∶2
9.下列各组物质各自形成的晶体,均属于分子晶体的化合物是
A. NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
10.下列说法正确的是
A. 离子晶体一定无共价键
B.分子晶体中一定无离子键
C.非极性分子中一定无极性键
D.全部由极性键构成的分子一定为极性分子
11.下列物质按沸点降低顺序排列的一组是
A. CI4、CBr4、CCl4、CF4 B.O2、S、Se、Te
C.HF、HCl、HBr、HI D.F2、Cl2、Br2、I2
12.下列诸因素中,可以解释水的熔、沸点比NaCl低的是
A. 分子中共价键比离子键弱
B.水是分子晶体,NaCl是离子晶体
C.水分子间有范德华力,NaCl分子间的化学键是离子键
D.水分子间是以范德华力相结合,相互间引力弱。NaCl晶体间Na+、Cl-以离子键相结合,作用力强
13.刚玉(Al2O3)是一种原子晶体,下列事实能说明这种结论的是
① Al2O3是两性氧化物;②硬度大;③它的熔点为2045℃;④几乎不溶于水
A. ①②③④ B.②③④ C.①③④ D.①②③
14.IA族元素的原子与最外层有7个电子的原子结合,可以形成
A. 离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
15.在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高,由此判断下列各组金属熔沸点高低,顺序正确的是
A. Mg > Al > Ca B.Al > NA.> Li
C.Al > Mg > Ca D.Mg > NA.> Al
二、填空题
1. (8分)在以下各过程中,未发生化学键破坏的是__________,仅发生离子键破坏的是__________,仅发生共价键破坏的是____________,既发生离子键破坏又发生共价键破坏的是__________。
①I2升华;②NH4Cl受热挥发;③烧碱熔化;④石英熔化;⑤NaCl溶于水;⑥HCl溶于水;⑦Br2溶于CCl4;⑧Na2O溶于水。
2.(10分)某种二氧化硅晶体的结构相当于把金刚石晶体中每个碳原子都换成硅原子,再在每两个硅原子连线的中点放置一个氧原子。
(1)判断下列关于二氧化硅晶体的叙述是否正确,正确的在括号中记“√”,不正确的记“×”。
①二氧化硅晶体中没有单个的“SiO2”分子存在。( )
②晶体中与同一硅原子相连的四个氧原子处于同一正四面体的四个顶点。( )
③与上述四个氧原子相连的另外四个硅原子也处于同一个正四面体的四个顶点。( )
(2)该晶体中由硅、氧原子组成的最小环上共有硅原子_____个,氧原子_______个。
3. (7分)有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的百分含量为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数与中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质名称叫_______,其晶体类型是_________。
(2)A和B形成化合物的分子空间构型为________,分子属______,其晶体类型是________,俗名________。
(3)A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_____________________。
三、综合题
1.(7分)石墨的片层与层状结构如右图:其中C—C键长为142pm,层间距离为340pm(1pm=10-12米)。试回答:
(1).片层中平均每个六圆环含碳原子数为 个;在层状结构中,平均每个六棱柱(如ABCDEF—A1B2C3D4E5F6)含碳原子数 个。
(2).在片层结构中,碳原子数、C—C键数、六元环数之比为 。
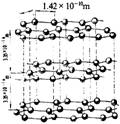
 (3).有规则晶体密度的求算方法:取一部分晶体中的重复单位(如六棱柱ABCDEF—A1B2C3D4E5F6),计算它们的质量和体积,其比值即为所求晶体的密度,用此法可求出石墨晶体的密度为 g/cm3(保留三位有效数字)。
(3).有规则晶体密度的求算方法:取一部分晶体中的重复单位(如六棱柱ABCDEF—A1B2C3D4E5F6),计算它们的质量和体积,其比值即为所求晶体的密度,用此法可求出石墨晶体的密度为 g/cm3(保留三位有效数字)。
2.(8分)右图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 ,该物质的化学式可表示为 。
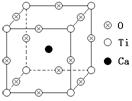 (3)若钙、钛、氧三元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1nm=10-9m),则该晶体的密度为
g·cm-3。
(3)若钙、钛、氧三元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1nm=10-9m),则该晶体的密度为
g·cm-3。
参考答案
一、选择题
1.D 2.D 3.B 4.B 5.BC 6.D 7.D 8.A 9.B 10.B
11.A 12.D 13.B 14.AC 15.C
二、填空题
1.①⑦;③⑤;④⑥;②⑧
2.(1)√√√(2)6,6
3.(1)金刚石,原子晶体(2)直线型,非极性分子,分子晶体,分子晶体,干冰(3)HClO4、H2CO3、Al(OH)3
三、综合题
1.2, 2, 2:3:1, 2.24
2.(1)6 8
(2)3:1:1 CaTiO3
(3)![]()
![]()