高三化学计算综合练习(二)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.设NA代表阿伏加德罗常数,下列说法正确的是
A.2.4g金属镁变成镁离子时失去的电子数目的0.1NA
B.2g氢气所含原子数目为NA
C.25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.17g氨气所含电子数目为10 NA
2.由NaH2PO4脱水形成聚磷酸盐Na200H2P200O601,共脱去水分子的数目为
A.198个 B.199个 C.200个 D.201个
3.在标准状况下,a L HCl 气体溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度为
A.a/22.4mol/L B.ab/22400mol/L
C.ab/(22400+36.5a)mol/L D.1000ab/(22400+36.5a)mol/L
4.只给出下列甲中和乙中对应的量,可以组成一个物质的量的公式的是
| ① | ② | ③ | ④ | ⑤ | |
| 甲 | 物质微粒数 | 标准状况气体摩尔体积 | 固体体积 | 非标况物质质量 | 溶液质量分数 |
| 乙 | 阿伏加德罗常数 | 标准状况气体体积 | 固体密度 | 物质的摩尔质量 | 溶液体积 |
A.①② B.①②③ C.①②④ D.①②⑤
5.已知2H2O(l)=2H2(g)+O2(g);ΔH=+517.6 kJ·mol-1 CH4(g)+2O2(g)=2H2O(l)+CO2(g);ΔH=-890.3 kJ·mol-1,将1 g H2和1 g CH4分别完全燃烧,放出热量之比为
A.1∶3.4 B.1∶1.7 C.2.3∶1 D.4.6∶1
6.3g镁、铝合金与100mL稀硫酸恰好完全反应,将反应后所得溶液蒸干,得到无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为
A.1 mol/L B.1.5 mol/L C.2mol/L D.2.5mol/L
7.X和Y两元素组成的化合物A和B,A的分子组成为XY2,其中X的质量分数为44.1%,B中X的质量分数为34.5%,则B的分子式为
A.X2Y B.XY3 C.XY D.X3Y
8.将固体NH4I置于密闭容器中,在某温度下发生下列反应:
①HN4I(固)![]() NH3(气)+HI(气);②2HI(气)
NH3(气)+HI(气);②2HI(气)![]() H2(气)+I2(气)。当反应达到平衡时,c(H2)=0.5
mol·L-1,c (HI)= 4 mol·L-1,则NH3的浓度为
H2(气)+I2(气)。当反应达到平衡时,c(H2)=0.5
mol·L-1,c (HI)= 4 mol·L-1,则NH3的浓度为
A.3.5 mol·L-1 B.4 mol·L-1 C.4.5 mol·L-1 D.5 mol·L-1
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.现有KCl、KBr的混合物3.87g,将混合物全部溶解于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为
A.0.241 B.0.259 C.0.403 D.0.487
10.有FeSO4、CuSO4混合液300mL,其中SO42-浓度为0.1mol·L-1,投入一些锌粉,反应后得到一些固体沉淀,经测定沉淀为Cu、Fe,不含Zn,溶液中还有0.01mol Fe2+。据此,可知投放的锌粉质量是
A.1.3g B.2.6g C.3.9g D.6.5g
11.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为
A.10% B.15% C.20% D.25%
12.在100mL含等物质的量的HBr和H2SO3的溶液里通入0.01molCl2,有一半Br- 变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075mol•L-1 B.0.008mol•L-1 C.0.075mol•L-1 D.0.08mol•L-1
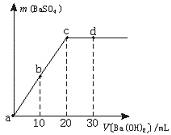 13.常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
13.常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
A.溶液的pH:a<b<c<d
B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性
D.c、d溶液呈碱性
14.食盐晶体由Na+ 和 Cl- 组成,这两种离子在空间的一个垂直方向都是等距离地交错排列。已知食盐的密度为2.2g/cm3,则食盐中相邻Na+核间的数值最接近于(![]() =2.8 ,
=2.8 ,![]() =1.414)
=1.414)
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
15.在120℃、1.01×105Pa时,将1L乙醇、乙硫醇(C2H5SH)的混合蒸气与5LO2混合,点火充分燃烧后恢复到原状况,气体的密度减小为燃烧前的10/11,则乙醇和乙硫醇的物质的量之比最接近于
A.2:3 B.1:3 C.1:4 D.1:5
16.用石墨电极电解100mL H2SO4与CuSO4的混合液,通电40min后,两极均收集到2.24 L气体,则原混合液中Cu2+的物质的量浓度和通过电解槽的电流分别为
A.1mol·L-1和16A B.1mol·L-1和32A C.2mol·L-1和16A D.3mol·L-1和8A
17.A气体(Cl2和NO2混合)和B气体(SO2和O2混合)的平均相对分子质量分别是51和48,将A、B气体混合后,通入盛满水的倒立在水槽中的试管,反应后试管中无气体存在,则A、B的体积比为
A.5∶2 B.1∶2 C.1∶1 D.4∶1
18.将a mol钠和a mol铝一同投入到m g足量水中,所得溶液密度为ρ g/mL,该溶液中溶质的质量分数为
A.![]() % B.
% B.![]() % C.
% C.![]() % D.
% D.![]() %
%
三、简答填空(26分)
19.(9分)常温下 A 和 B 两种气体组成混合气体(A 的相对分子质量大于 B 的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论 A 和 B 以何种比例混合,氮和氢的质量比总大于 14/3。由此可确定 A 为_____________,B 为____________,其理由是__________________。
若上述混合气体中氮和氢的质量比为 7∶1,则在混合气体中 A 和 B 的物质的量之比为________;A 在混合气体中的体积分数为_____%。
20.(10分)计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在温度为t℃和压力为pPa的情况下,19.5g A 与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。
缺少的数据是:
计算式为m=
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积(![]() )
)
缺少的数据是:
计算式为:
21.(7分)NaHCO3和KHCO3的混合物9.20g和100mL 盐酸反应。
⑴若NaHCO3和KHCO3的物质的量相同,
①试分析,欲求标准状况下生成CO2的体积时,还需什么数据(用a、b等表示,要注明)。答: ;
②求标准状况下生成CO2的体积:
| 所需数据的取值范围 | 生成CO2的体积(标准状况) |
| 盐酸不足时: | |
| 盐酸过量时: |
⑵ 若NaHCO3和KHCO3不是等物质的量混合,则9.20g固体与足量盐酸完全反应时,在标准状况下生成CO2的体积大于 L;小于 L。
四、分析推理(10分)
22.(10分)聚氯乙烯![]() 是最早工业化生产的最重要塑料品种之一,其具有价格低廉、难燃等优点,因此产量仅次于聚乙烯居第二位。但是,其加工过程中需要使用多种有毒添加剂。有毒的添加剂会渗出对人类造成危害;另外,其燃烧值低,聚乙烯
是最早工业化生产的最重要塑料品种之一,其具有价格低廉、难燃等优点,因此产量仅次于聚乙烯居第二位。但是,其加工过程中需要使用多种有毒添加剂。有毒的添加剂会渗出对人类造成危害;另外,其燃烧值低,聚乙烯![]() 等烯烃聚合物燃烧产生的能量与燃油相当,而聚氯乙烯产生的能量仅与纸张相当,且有剧毒的二噁英的生成(二噁英是目前对人类最毒的物质)。
等烯烃聚合物燃烧产生的能量与燃油相当,而聚氯乙烯产生的能量仅与纸张相当,且有剧毒的二噁英的生成(二噁英是目前对人类最毒的物质)。
(1)计算聚氯乙烯中氯的质量分数 。
(2)聚氯乙烯、聚乙烯的原料都为石油。其中,聚乙烯中的![]() 都来自于石油;而聚氯乙烯中的
都来自于石油;而聚氯乙烯中的![]() 除来自于石油外,还有HCl。现有1t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)
。
除来自于石油外,还有HCl。现有1t石油,试计算可得出多少吨聚乙烯和聚氯乙烯(理论上假设石油的全部成分为碳和氢,并且在生产聚乙烯、聚氯乙烯的过程中没有碳原子和氢原子的损失)
。
(3)试根据上述信息及计算结果,谈谈该如何对待聚氯乙烯的使用。
五、数形结合问题(20分)
23.(10分)在常温常压下,把a mol的NH3和O2的混合气充入密闭容器中,在催化剂存在下加热 ,使其充分反应,然后恢复到原来的温度和压强。
(1)写出容器内NH3被氧化和形成HNO3的化学方程式。
(2)若原混合气中O2的体积分数为x,最后在容器中生成的HNO3为ymol。
 请填写下表.
请填写下表.
| X的取值范围 | 用x表示的y值表示式 |
(3)在坐标图上画出y=f(x)的关系曲线.
24.(10分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
 (1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(1)根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
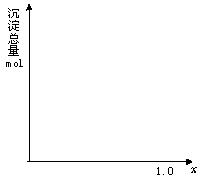
(2)计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随x(0→1)变化的曲线。
(3)若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
化学计算综合练习(二)参考答案
| 1 | D | 2 | B | 3 | D | 4 | C | 5 | C |
| 6 | B | 7 | B | 8 | D | 9 | C | 10 | A |
| 11 | D | 12 | D | 13 | D | 14 | C | 15 | C |
| 16 | A | 17 | A | 18 | C |
| |||
19. N2 ;NH3 。 纯 NH3 中氮和氢质量比为 14/3,在纯 NH3 中混入任何比例的 N2,都将使氮和氢质量比大于 14/3。 1∶4;20。
20.⑴在t℃和pPa下D气体的密度 (ag·L-1)
19.5g + 11.0g - 3.00L×ag·L-1
⑵ 盐酸的浓度(bmol·L-1 )
当 ![]() ,
, ![]()
当 ![]() ,
, ![]()
21. ⑴ ① 答: 盐酸的物质的量浓度a mol·L-1 ;②
| 所需数据的取值范围 | 生成CO2的体积(标准状况) |
| 盐酸不足时:a ≤ 1 mol·L-1 | 2.24 a L |
| 盐酸过量时:a > 1 mol·L-1 | 2.24 L |
⑵ 2.06 L ; 2.45 L 。
22.(1)![]()
(2)根据质量守恒定律,1t石油可得1t聚乙烯
依题意,石油成分为C和H,且全部转移到聚氯乙烯中,则:
![]()
1t石油可生产聚氯乙烯:
![]()
即2.4t
(3)以上计算表明,石油生产聚氯乙烯的产出率高,生产聚氯乙烯较聚乙烯价格低廉,应充分利用。由于聚氯乙烯中的有毒添加剂渗出对人体造成危害,应避免使用聚氯乙烯制品盛装食物、药品等。又由于聚氯乙烯燃烧值低,且燃烧时有剧毒物生成,应避免焚烧。(其它合理答案也给分)
23.解:(1)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
2NO+O2![]() 2NO2
2NO2
3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
| x | Xy |
| 0<x≤ | Y=0 |
|
| Y=(3x- |
|
| Y=(1-x)a |
 (2)
(2)
(3)
24.解:
(1)有0.06 mol Fe(OH)3沉淀,
(2)0≤x≤0.6 (见下图)
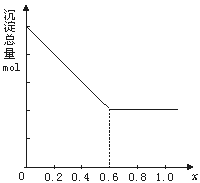
(3)Fe(OH)3的物质的量为A(1-x)mol,
Al(OH)3物质的量为[A(x+3)-0.36]mol
(x取值范围:![]() -3≤x≤1)
-3≤x≤1)