高 三 化 学(第16周)
【教学内容】
高三化学《酸碱盐》
【教学目标】
1、掌握常见的酸、碱、盐的性质,PH值概念、电解质和非电解质
2、掌握单质、氧化物、酸、碱、盐相互间的关系
【知识讲解】
本章是无机化合物的有关知识的总结和概括,涉及到单质、氧化物、酸、碱、盐的性质及其相互转化关系,复习这一章内容应将整个高中阶段有关元素化合物知识联系起来,特别是与选修本上有关电解质溶液一章内容联系起来复习,既要掌握物质的共性规律性,又要掌握其个性特殊性。
一、电解质和非电解质
1、定义:在水溶液中或熔化状态下能导电的化合物——电解质
在水溶液和熔化状态下都不能导电的化合物——非电解质
对这二个概念的理解上,首先要明确不管是电解质还是非电解质均为化合物,而不是混合物(除氨水、盐酸为特例属于电解质),特别要注意混合物不能称电解质,也不能根据物质的导电性来判断,根据定义,显然,化合物不是电解质即为非电解质。
![]() 强电解质——水溶液中不存在电离平衡的电解质
强电解质——水溶液中不存在电离平衡的电解质
![]() 电解质
电解质
弱电解质——水溶液中存在电离平衡的电解质
化合物
非电解质
例1:下列物质哪能些属于电解质?哪些属于非电解质
①液态氯化氢 ②浓H2SO4 ③AgCl ④熔化的KNO3 ⑤酒精溶液
⑥液态蔗糖 ⑦乙醛 ⑧乙酸 ⑨SO2 ⑩Cu
(电解质①③④⑧,非电解质⑥⑦⑨)
例2:下列说法正确的是
A、 稀硫酸能导电,稀硫酸为电解质。
B、能导电的化合物一定是电解质。
C、Na2CO3固体不导电,是因为没有离子存在。
D、CaCO3不溶于水,因此为非电解质。
(正确答案B)
常见强电解质:绝大多数盐类、强酸、强碱[ⅠA、ⅡA(除Be、Mg)],部分氧化物(Na2O、Al2O3)
弱电解质:弱酸、弱碱(一般指不溶性),个别有机物以及极弱电解质水。
判断强弱电解质除运用上述知识外,还可通过以下方法来判断:
① 运用元素周期律知识。
② 根据酸、碱物质的量浓度与之对应的PH值来判断。
③ 根据盐溶液的PH值来判断。
例:已知0.1mol/L的甲酸PH值不等于1,说明甲酸是强电解质还是弱电解质?
已知甲酸钠溶液PH值大于7,说明甲酸是强酸还是弱酸?
![]() 利用强酸制弱酸原理
利用强酸制弱酸原理
④ 根据化学反应来判断
利用复分解反应原理
例:硫酸铅既不溶于水,也不溶于酸,但能溶于CH3COONH4.
![]() 请写出H2S与Pb(CH3COO)2
请写出H2S与Pb(CH3COO)2
反应的离子方程式。
解析:本题隐含一条重要信息:PbSO4和CH3COONH4反应的基本类型为复分解反应。复分解反应发生的条件是有气体或沉淀或水(实质形成弱电解质),显然(NH4)2SO4为强电解质,只有Pb(Ac)2为难电离物质,因此,H2S和Pb(Ac)2反应的离子方程式即为它们反应的化学方程式![]() 。
。
2、电解质能导电的原因——存在自由移动的离子。
![]() 溶于水——水分子作用,破坏其化学键
溶于水——水分子作用,破坏其化学键
电解质
![]() 自由移动离子
自由移动离子![]() 过程称
过程称
熔融——热能作用、破坏离子键
3、电解质的电离——物理变化,注意与电解概念的区别和联系。
电解一定发生的是化学变化,电离不需通电。电解是建立在电离的基础上。
4、电离度(α)——明确只有弱电解质才讲电离度。
![]()
![]()
![]()
![]() 思考:CH3COOH
CH3COO-+H+-Q 改变下列条件中的一个,平衡向哪个方向移动?电离度如何变化?[H+]如何改变?
思考:CH3COOH
CH3COO-+H+-Q 改变下列条件中的一个,平衡向哪个方向移动?电离度如何变化?[H+]如何改变?
①增大CH3COOH浓度 ②升温 ③加水稀释
(①→,α减小,[H+]增大; ②→,α增大,[H+]增大;③→,α增大,[H+] 减小)
二、酸
![]() 1、定义:电解质电离产生的阳离子全部是H+的化合物。
1、定义:电解质电离产生的阳离子全部是H+的化合物。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 对该定义要全面分析理解,象H2O、 OH 电离出的阳离子亦都是H+,中学里不能称为酸的。
含氧酸(H2SO4、HNO3等)
对该定义要全面分析理解,象H2O、 OH 电离出的阳离子亦都是H+,中学里不能称为酸的。
含氧酸(H2SO4、HNO3等)
2、分类 (1)酸中组成元素
无氧酸(HCl、H2S等)
![]() 一元酸
一元酸
(2)酸分子完全电离产生H+数 二元酸
多元酸
注意:能否根据酸分子中H原子数确定酸是几元酸?例如:H2C2O4、H2CO2、H4C2O2它们分别是几元酸?
![]() O
O
![]() 对于含氧酸,应根据酸分子中——OH数目确定,H2C2O4(C—OH)二元酸、H2CO2
对于含氧酸,应根据酸分子中——OH数目确定,H2C2O4(C—OH)二元酸、H2CO2
![]() C—OH
C—OH
![]()
![]() O
O
O
O
O
O
(H—C—OH)为一元酸H4C2O2(CH3—C—OH)为一元酸。对常见的酸要会判断:
O
![]() ↑
O
↑
O
![]() HNO3(HO—NO2),H2SO4(HO—S—OH),H3PO4(HO—P—OH);不熟悉的根据信
HNO3(HO—NO2),H2SO4(HO—S—OH),H3PO4(HO—P—OH);不熟悉的根据信
↓ OH
O
息去判断。
例如:H3PO3(亚磷酸)与NaOH反应,只能形成二种钠盐,NaH2PO3和Na2HPO3,请问H3PO3为几元酸?(二元酸)
![]() 强酸
强酸
(3)根据酸是否完全电离
弱酸
判断方法:①同种元素形成多种含氧酸,化合价高的酸性强,如HClO、HClO2、HClO3、HClO4;H2SO4和H2SO3等。
②运用元素周期律知识。
③利用盐和酸反应原理(强酸制弱酸)
3、命名(1)无氧酸——氢某酸
![]() 一般称某酸
一般称某酸
(2)含氧酸
化合价不同的另加次、亚、高等
(3)原某酸和偏某酸——中心元素化合价相同。
原某酸——中心元素化合价与分子中—OH数目相等,如H4SiO4、H3AlO3等,原酸失去水分子即为偏酸。
例1 下列反应生成的盐的名称与酸不再对应的是
A、HPO3+KOH(冷)— B、H4SiO4+NaOH—
C、Al(OH)3+NaOH— (答:B、C)
例2 碳与硅同族,硅可形成原硅酸和偏硅酸(即H2SiO3),碳也能形成原碳酸,请写出原碳酸甲酯的结构简式。
![]()
![]() OH
OH
OH
OH
![]()
![]() 分析:原硅酸为HO—Si—OH,根据同族元素性质的相似性,原碳酸为HO—C—OH,
分析:原硅酸为HO—Si—OH,根据同族元素性质的相似性,原碳酸为HO—C—OH,
OH OH
与甲醇酯化时,酸提供羟基,醇提供氢。正确答案为C(OCH3)4.
4、酸的性质
(1)通性——为什么酸具有相似的化学性质?(电离出来的阳离子均为H+)
①酸碱指示剂反应。
![]() 金属活动性顺序氢前的金属
金属活动性顺序氢前的金属
②金属与酸的反应
变价金属只能被H+氧化为低价
③碱性氧化物的反应
④![]()
![]() 碱的反应——中和反应
CaCO3+HCl—
碱的反应——中和反应
CaCO3+HCl—
![]() 强酸制弱酸如:
强酸制弱酸如:
⑤与某些盐的反应 Ca(ClO)2+H2O+CO2
NaCl+H2SO4(浓)—
不挥发性酸制挥发性酸如:
NaNO3+H2SO4(浓)—
注意:a、特殊的弱酸制强酸CuSO4+H2S=CuS↓+H2SO4
b、多元酸正盐与酸反应转化为酸式盐
思考:BaSO4既不溶于水也不溶于硝酸,但能溶于某种无色液体,所得混合物缓缓倒入水中,又生成白色沉淀,问某种无色液体是什么?
[浓H2SO4、形成Ba(HSO4)2]
(2)还原性酸
FeCl3+HI— Fe2(SO4)3+H2S— Cl2+H2SO3—
![]()
![]() ——
——
具体应用:除上述反应外。①测定酸雨PH值,随时间延长,PH值减小![]() 。
。
②![]() 溶液无明显现象,加入
溶液无明显现象,加入![]() 溶液,有白色沉淀(
溶液,有白色沉淀(![]() 氧化性,将
氧化性,将![]() 氧化为
氧化为![]() ,形成
,形成![]() 沉淀)。
沉淀)。
③欠置的氢硫酸溶液变浑浊(![]() )。
)。
(3)氧化性酸
①Al、Fe遇冷浓HNO3、浓H2SO4钝化。
②C、S、P等非金属均能被热浓HNO3氧化。
③不活泼金属Cu等能被HNO3、浓H2SO4(热)氧化。
(4)既具氧化性又具有还原性酸,如HNO2、H2SO3。
(5)酸的分解
完成下列反应方程式,注明必要条件
![]() ——
——
![]() ——
—— ![]() ——
—— ![]()
(6)酸的特殊反应
①酸与酸的反应,如H2SO3与硝酸或HClO或H2S的反应
![]() HX与醇→卤代烃
HX与醇→卤代烃
②酸与醇的反应
含氧酸与醇→酯
③酸与酸性氧化物反应,如HF+SiO2—— , HNO3+SO2——
④酸能发生银镜反应, ![]()
O
![]()
![]()
![]()
![]() ↑
↑
思考:硫酸的结构式为H—O—S—O—H其共价键①、②、③、④在不同反应中均可能
④ ③↓② ①
O
断裂。请各举一例,使下列化学键断裂的化学反应。
a、仅①断 b、① ④断 c、① ③断 d、仅②断 e、② ③断
(答案 a、![]()
b、![]() c、
c、![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() d、 +
d、 +![]()
![]()
e、![]() )
)
三、碱
(一)NaOH——苛性钠、火碱、烧碱
![]() 电解饱和食盐水
电解饱和食盐水
1、制法
熟石灰与纯碱反应——既是工业制法,也是实验室制少量NaOH方法。
2、物理性质——掌握极易溶于水(空气中潮解、作干燥剂),放出大量热(配制溶液时先溶解后冷却)。由于强腐蚀性,称量NaOH固体不能在纸上称量,应在玻璃器皿中称量。
3、化学性质:
![]()
![]() CO2
CO2
![]() 酸性氧化物
酸性氧化物 ![]() NaOH保存(密封、像皮塞)
NaOH保存(密封、像皮塞)
①氧化物 SiO2
两性氧化物Al2O3
特殊氧化物 ![]()
(制HNO3尾气吸收)
②酸碱指示剂
思考:如何证明Na2CO3溶液是否混有NaOH?
(答:取样品加入酚酞试液,然后加过量BaCl2溶液,若红色不褪证明含NaOH,若红色褪去证明不含NaOH)
③某些金属![]() (了解Be、Zn亦能与NaOH溶液反应)
(了解Be、Zn亦能与NaOH溶液反应)
思考:熔化NaOH固体,可选用的坩埚是
A、瓷坩埚 B、铁坩埚 C、Al2O3坩埚 D、石墨坩埚
④某些非金属![]() (属置换反应)
(属置换反应)
![]()
![]()
![]() (属歧化反应)
(属歧化反应)
⑤与酸的反应(所有酸)
思考:a、醋酸与NaOH按1:2的物质的量比混合,蒸干灼烧,最后所得固体是什么?
(答:Na2CO3、因为![]()
![]() )
)
b、硬脂酸(![]() )不溶于水,因而不能使指示剂变色,如何证明其具有酸性?
)不溶于水,因而不能使指示剂变色,如何证明其具有酸性?
(答:在热的NaOH溶液中加入酚酞,然后加入硬指酸,红色逐渐变浅。)
⑥与盐反应:
a、 用于鉴定阳离子存在如:
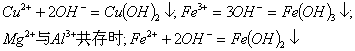
![]()
![]() →
→![]()
![]() (既用于鉴定NH4+,又用于实验室制NH3)
(既用于鉴定NH4+,又用于实验室制NH3)
![]() 注意两者物质的量之比,如
注意两者物质的量之比,如![]()
b、与酸式盐反应 注意是何种盐,如![]() 只有当NaOH足量才能生成
只有当NaOH足量才能生成![]() 一定生成Mg(OH)2沉淀等。
一定生成Mg(OH)2沉淀等。
![]()
![]()
![]() OH ONa
OH ONa
![]()
![]()
![]() ⑦酚 +NaOH→ +H2O(证明苯酚具有酸性)
⑦酚 +NaOH→ +H2O(证明苯酚具有酸性)
思考:检验苯酚存在时,可利用如下反应:
![]() OH
OH
![]()
![]()
![]() 6 +Fe3+ [Fe(C6H5O)6]
3—+6H+,在进行该实验时,适宜在PH值较大还是较
6 +Fe3+ [Fe(C6H5O)6]
3—+6H+,在进行该实验时,适宜在PH值较大还是较
小的条件下进行?能否在强碱性条件下进行?
答:(PH值较大、不能、否则生成Fe(OH)3沉淀)
![]() NaOH水溶液发生水解反应
NaOH水溶液发生水解反应
⑧卤代烃
NaOH醇溶液发生消去反应
⑨酯在NaOH存在下的水解反应
(二)Ca(OH)2——熟石灰、消石灰
制法![]() 涉及
涉及![]() 应用的有:
应用的有:
1、工业生产无水酒精 2、炼铁、炼钢、生产水泥、玻璃、电石等工业
3、实验室作干燥剂 4、煤中S的固定(其原理是:![]()
![]() )
)
四、盐
![]() 正盐——酸碱完全中和后的产物如NaCl等。
正盐——酸碱完全中和后的产物如NaCl等。
酸式盐——酸中H+部分被中和的产物如NaHCO3等。
1、分类(1)组成 碱式盐——碱中OH-部分被中和的产物如Cu2(OH)2CO3等。
复盐——一种酸根离子和多种金属离子组成如KAl(SO4)2等。
络盐——如冰晶石(Na3AlF6)。
![]() 强酸强碱盐——不水解(不一定是中性如NaHSO4)
强酸强碱盐——不水解(不一定是中性如NaHSO4)
强酸弱碱盐——水解呈酸性
(2)酸碱性强弱 强碱弱酸盐——水解呈碱性
弱酸弱碱盐——水解溶液酸碱性看酸,碱相对强弱
2、化学性质
(1)金属与盐
如:![]()
注意:①金属排在金属活动顺序前面且盐要可溶。
②活泼金属与盐溶液反应时,金属先与水反应如![]()
③![]() 两个反应是置换出H2。
两个反应是置换出H2。
![]() ④
④![]() (熔融)
(熔融) ![]() 是因为K的沸点比Na低而发生。
是因为K的沸点比Na低而发生。
⑤![]() —是因为
—是因为![]() 的氧化性而发生。
的氧化性而发生。
(2)盐+酸、盐+碱的反应前面已复习。
(3)盐+盐的反应。
①复分解反应。![]() —
—
Al3+ HCO3-(CO32-)
②相互促进水解。 Fe3+(Fe2+) 与 S2-(HS-)
NH4+ SiO32-、AlO2-
ClO-
③氧化—还原反应。 Fe3++I-- Fe3++S2-—
![]() ④不能进行到底(离子大量共存)
④不能进行到底(离子大量共存)![]()
![]()
思考:a、FeCl2溶液中加入NaClO溶液有何现象?
(有红褐色沉淀,Fe2+被ClO-氧化,同时Fe3+与ClO-相互促进水解。
b、两种钠盐晶体共热,产生刺激性气味气体,将此气体制成浓溶液与MnO2共热,产生黄绿色气体,问两种钠盐晶体是什么?)
(答:NaCl和NaHSO4)
(4)盐的分解 ![]()
![]()
![]()
思考:将FeC2O4在空气中加热,可制得FeO,该反应为:
![]() ,问,为何在空气中加热能制得FeO?
,问,为何在空气中加热能制得FeO?
(答:CO2起隔绝O2作用,CO又起还原性保护气作用)
(5)非金属+盐 ![]()
![]()
![]()
思考:写出Cl2与FeBr2溶液按物质的量比1:1和3:2反应的离子方程式(答:
![]() )
)
(6)盐溶液电解(惰性电极)
阴极:阳离子放电顺序 Ag+>Cu2+>H+(一般不考虑H前阳离子放电)
阳极:阴离子放电顺序 S2->I->Br->Cl->OH-(一般不考虑SO42-、NO3-等放电)
【能力训练】
在一定条件下,可实现下图所示物质间变化
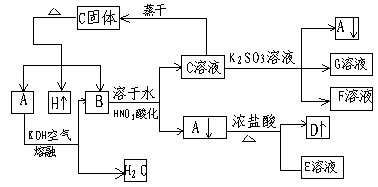
D为黄绿色气体,请填空
(1)A→B化学方程式 __________________
(2)写出下列变化的离子方程式
B→C+A ______________________________
A→D+E ______________________________
C→A+F+G ____________________________
【能力训练答案】
(1)![]()
(2)![]()
![]()
![]()