高三化学单元测试六
一、选择题(每小题5分,共30分。每小题有一个或两个选项符合题意)
1.仪器中刻度位置正确的是
A.25mL碱式滴定管的25mL刻度在最下端
B.量筒“0”刻度在筒底最下平面上
C.托盘天平游码刻度尺的“0”标线位于中央
D.容量瓶体积标线刻于瓶颈上呈圈状水平环
2.下列实验操作中正确的是
A.pH试纸要润湿后才能测溶液的pH
B.振荡试管应三指握,腕动臂不摇
C.洗涤滤纸上的滤渣要连续小心注水,直到洗净
D.称量固体烧碱必须在秤盘上垫纸片
3.实验室制取下列干燥气体,可以使用相同的发生装置和相同的收集方法,并且可以使用相同干燥剂的是
A.H2、CO2 B.Cl2、HCI C.CH4、O2 D.CO2、NO
4.为了除去CO2中混有少量的O2、H2S、HCl和水蒸气,现用下列四种试剂:①浓H2SO4,②CuSO4溶液,③饱和NaHCO3溶液,④红热铜丝。混合气体通过试剂的顺序最合理的是
A.②、①、④、③ B.②、③、①、④
C.③、④、①、② D.④、①、②、③
5.某学生设计了如下四个实验方案,用以检验淀粉的水解程度,其中操作和结论均正
确的是
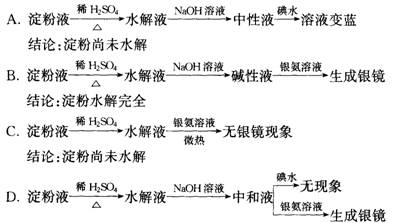
结论:淀粉水解完全
6.有标号A、B、C、D的四瓶无色液体,分别为NaCl溶液、NaOH溶液、稀盐酸(物质的量浓度均为0.lmol·L一1)和酚酞试液(质量分数为0.1%)。某学生用以下实验步骤进行鉴别:①各取少许溶液两两混合,将四种溶液分成两组;②取某一组混合液,向其中不断滴入另一组中的一种未知液,可鉴别出A和B;③取出A溶液2mL,滴入3滴C溶液,再加人4mL D溶液,此过程无明显现象。则A、B、C、D依次是
A.稀盐酸、NaCl溶液、NaOH溶液、酚酞试液
B.NaCl溶液、NaOH溶液、稀盐酸、酚酞试液
C.酚酞试液、稀盐酸、NaOH溶液、NaCl溶液
D.NaOH溶液、稀盐酸、酚酞试液、NaCl溶液
二、填空和问答题(共70分)
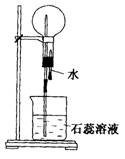 7.(8分)A是一种白色晶体,它与NaOH浓溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按右下图安装仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按右下图安装仪器,挤压滴管的胶头时,可以得到红色喷泉。
7.(8分)A是一种白色晶体,它与NaOH浓溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按右下图安装仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按右下图安装仪器,挤压滴管的胶头时,可以得到红色喷泉。
(1)A的化学式是_____________。
(2)可用于除去B中水分的干燥剂是___________
收集气体B的方法是________
(3)收集气体C的方法是___________
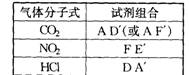
8.(6分)欲利用下面的装置在实验室中制取气体。
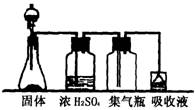
可供选择的固体有:
A.CaCO3 B.FeS C.CaC2 D. NaCl E.Zn
可供选择的液体有:
A'.浓H2SO4 B'.稀H2SO4
C'.浓HCI D'.中等浓度盐酸
E'.浓HNO3 F'.稀HNO3
能获得较为纯净的气体(不考虑水蒸气)的正确组合是
9.(16分)实验室常用Cu与稀硝酸反应来制取NO气体。今有某学生设计的用氨催化氧化制取NO气体的装置如下图所示(NH3在氧化过程中转化率可达90%左右)。在合成NO的反应过程中不能出现气体颜色变化,并且要观察到由合成的NO直接转化为NO2的颜色变化。已知Fe2++nNO=[Fe(NO)n]2+。
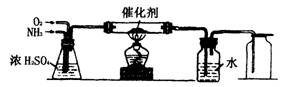
(1)你认为这套装置能达到实验目的吗?_____(能或不能)
理由是:________________________
(2)如果要达到上述实验目的,如何改进才是一套完整的实验装置?
改进方法是__________________
改进的目的或理由是__________________
(3)实验开始时应先_____________,目的是________________。
10.(13分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
① 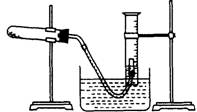 把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放
把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放
入干燥的试管中,准确称量,质量为a g;
②装好实验装置;
③检查装置气密性;
④加热,开始反应,直到产生一定量的气体;
⑤停止加热(如右图,导管出口高于液面);
⑥测量收集到的气体的体积;
⑦准确称量试管和残留物的质量为bg;
⑧测量实验室的温度;
⑨把残留物倒人指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净;
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性?________________________
(2)以下是测量收集到的气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:________________。(请填写步骤代号)
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同?
_____________________________________
(4)如果实验中得到的氧气体积是c L(25℃、1.01 ×105 Pa)。水蒸气的影响忽略不计,则氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=________________________.
11.(15分)1, 2, 3, 4一四氢化萘的结构简式是![]() ,分子式是C10H12常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:
,分子式是C10H12常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:![]() 。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
①按一定质量比把四氢化萘和水加人适当的容器中,加人少量纯铁粉。
②慢慢滴人液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒人分液漏斗中,静置。
④分液,得到的“水层”即氢溴酸溶液。
回答下面问题:
(1) 下面示意图中的装置,适合步骤①和②操作的是_____________。
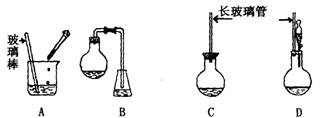
(2)步骤②中如何判断“反应完全”_______________
(3)步骤③中补充少量四氢化蔡的目的是_________________
(4)步骤③中过滤后得到的固体物质是______________
(5)已知在实验条件下,饱和氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中四氢化萘和水的质量比约是1:_____(保留小数点后1位)。
12.(12分)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。

单元测试六 化学实验答案
一、选择题(每小题5分,共30分)
1.D 2.B 3.BC 4.B 5.D 6.AB
二、填空题(共70分)
7.(1)NH4Cl
(2)碱石灰(或答生石灰、KOH固体等任一种不与氨反应的干燥剂)
向下排气法
(2) 向上排气法
8.
9.(1)不能,2NH3+H2SO4═(NH4)2SO4,NH3被吸收,无法进人硬质试管参加反应。
(2)在NH3进人反应器前,先通过饱和氨水,观察气泡逸出速率,使NH3的逸出速率与O2在浓H2SO4中的逸出速率>4:5,以保证NH3过量,然后使NH3通过盛有碱石灰的干燥管后,再进入反应器进行催化氧化。
在集气瓶上应连接带导管的双孔塞,将多余气体导人盛溴FeSO4溶液的烧杯中来吸收尾气,防止NO污染空气,同时阻止空气进人集气瓶,氧化生成NO。
(3)在实验开始前应先通人NH3,排净装置中的空气,防止生成的NO被氧化,在反应过程中就出现颜色变化。
10.(1)将导管的出口浸人水槽的水中,手握住试管,溴气泡从导管口逸出,放开手后有少量水进人导管,表明装置不漏气。
(2) ②①③
(3) 慢慢将量筒下移。
(4) ![]()
11.(1)D (2)加入的液溴颜色基本不褪
(3)除去过量的溴)(4)四溴化萘、铁粉(5)1.3
12.
