高三化学单元测试五
一、选择题(每小题5分,共30分。每小题有一个或两个选项符合题意)
1. 设NA为阿伏加德罗常数,如果ag某气体的分子数为p,则bg该气体在标准状况下的体积V(L)是:

2. 质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水(没有晶体析出),得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的相对分子质量为

3. 将ag含NaOH样品溶解在b mL 0.1lmol•L_1的硫酸中,再加入c mL 0.1 lmol•L_1的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是:
A.[(b一c)/125a]×100% B.[(b一2c)/125a]× 100%
C.[(b一c)/250a]×100% D.[(8b一8c)/125a]×100%
4. 将足量的CO气体通入灼热的某种铁的氧化物Wg,充分反应后残留固体质量为mg,生成n g CO2。则该氧化物中铁元素的化合价是:

5.某温度下CuSO4的溶解度是25g,若温度不变,将32g无水CuSO4粉末撒人n g水中形成饱和溶液,并有CuSO4•5H2O晶体析出,则n的取值范围是:
A.18≤n≤128 B.36≤n≤180 C.18<n<128 D.36<n<180
6.在CO和CO2的混合气体中,氧元素的质量分数为64%。将该混合气体5g通过足量的灼热的氧化铜,充分反应后,气体再全部通人足量的澄清石灰水中,得到的白色沉淀的质量是:
A.5g C.15g B.l0g D.20g
二、填空题(40分)
7.(9分)在25℃、l01kPa条件下,将15LO2通入l0L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1) 若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)=___________L, V (H2)=___________L;
(2)若剩余气体的体积是aL,则原CO和践的混合气中
V(CO):V(H2)=___________;
(3)若剩余气体的体积是a L,则a的取值范围是___________
8.(8分)某温度t℃时,水的Kw=10-13,则该温度应_____(填写>、<或=)25℃,理由是______________。将该温度下pH=11的a L NaOH溶液与pH=1的b LH2SO4溶液充分混合(忽略溶液体积的变化),则有:
(1) 若所得混合溶液为中性,则a:b=_____________;
(2)若所得混合溶液的pH=2,则a:b=_____________。
9.(9分)在体积为2L的密闭容器中,保持一定温度发生下列反应:
3A (g)![]() 2B(g)+C(g)。
2B(g)+C(g)。
已知加人lmol A气体达到平衡(I)时,生成0.5mol B和0.25mo1 C。
(1) 若起始时加人xmol A、ymol B和0.2mo1 C,欲使平衡时各气体的体积分数与平衡(I)时完全相同,x、y分别应满足的条件是:_________________。
(2) 若在平衡(I)时,加人4mo1 A,再达平衡时,B的浓度为:_________
(3)若在平衡(I)时,加人足量物质B,则物质A的物质的量变化值q的取值范围是:
___________________________。
10.(14分)分别取等物质的量浓度的氢氧化钠溶液各100mL,再通人一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴人0.2lmol•L_1的盐酸,在标准状况下产生CO2的体积(y轴)与所加人盐酸的体积(x轴)的关系见下图(分(a)、(b)两种情况):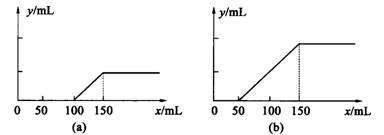
(1) 在(a)情况下,溶质是______(填化学式)其物质的量之比为___________
(2)在(b)情况下,溶质是_________(填化学式)其物质的量之比为_____________
(3)在(a)、(b)两种情况下产生CO2的最大体积各为_______mL和_______mL。
(4)原氢氧化钠溶液的物质的量浓度为:_________________。
三、问答题(30分)
11.(14分)加热0.08mol KmnO4一段时间后,收集到a mol气体。将反应后的残留固体加人足量的浓盐酸,加热,又收集到b mol气体。设此时Mn元素完全转化为Mn2+存在于溶液中,试通过计算回答下列问题:
(1) a十b的范围如何?
(2)当a+b=0.18mo1时,加热后的残留固体质量为多少克?
12.(16分)将一定量的Na2CO3和NaHCO3的混合物粉末加热完全反应,将生成的气体通过20℃时539g的饱和石灰水,反应完全后生成白色沉淀1g,往加热后的残留物里加人足量盐酸,生成气体1.12L(标准状况)。计算原混合物中NaHCO3和Na2CO3的物质的量之比(氢氧化钙在20℃时的溶解度为0.165g)。
单元测试五 化学计算答案
一、选择题(每小题5分,共30分。若正确答案包括两个选项,选一个且正确给2分。但只要选错一个,该小题为0分)
1 .D 2.C 3.A 4.AD 5.C 6.C
二、填空题(40分)
7.(1)5, 5(2)(3)10<a<20
8.>,温度升高,促进水的电离,KW增大。 (1)10:1(2)9:2
9.(1)y=0 .4,x>0
(2)1.25mol.L-1
(3)0<q<0.75mol
10.(1)NaOH、Na2CO3、1:1
(2)NaCO3、NaHCO3,1:1
(3)224、448
(4)1.5mo1.L一1
三、问答题(30分)
11.(1)先分两种情况讨论:①若KMnO4全部分解
2KMnO4一 K2MnO4 一 MnO2 一 O2↑
0.08mol 0.04mo1 0.04mol 0.04mol
K2MnO4一2O2 MnO2一C12
0.04mol 0.08mol 0.04mol 0.04mol
则a+b=0.04+0.08+0.04=0.16mo1
②设KMnO4完全不分解:2KMnO4一5 C1
0.08mol 0.2mol
则a+b=0 .2mo1
但因是加热一段时间,收集到a molO2,再将残留固体与浓盐酸反应(加热),又收集到bmolCl2,所以0.16≤a+b<0.2
(2) 2KMnO4一 K2MnO4 一 MnO2 一 O2↑
2xmol xmol xmol xmol
2KMnO4一 5CI2 K2MnO4 一2C12 MnO2 一 C12↑
(0.08一2x)mol (0.2一5x)mol xmol 2xmol xmol xmol
则有a+b=x+0.2一5x+2x+x=0.18
x=0.02mol
加热后的残留固体质量为0.08 × 158g-0.02×32g=12g
12.设539g饱和石灰水含Ca(OH)2的质量为xg
539:x=100:0.165 x=0.8888g
![]()
又设Na2CO3、NaHCO3的物质的量各为a、b,则