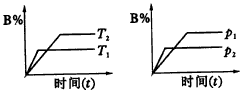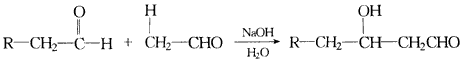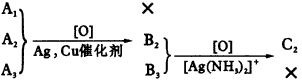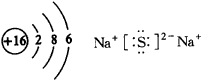高三化学第二轮专题复习—考点与练习
| 考点与练习(之一) | ||||||||||||||||||||||||||||||
| Ⅰ.基本概念、基本理论
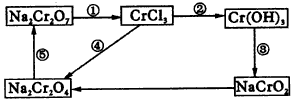
(1)在上述有编号的步骤中,需用还原剂的是____________,需用氧化剂的是____________。
②现向含有1molKI的硫酸溶液中加入含amolKBrO3的溶液,a的取值不同,所得产物也不同。试将讨论的结果填入上表。
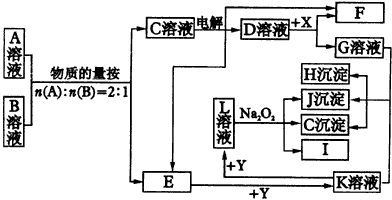
根据上述一系列转化关系回答:
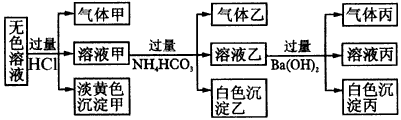
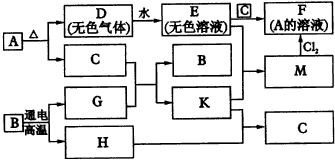
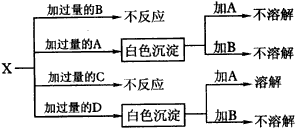
①H溶液和I溶液混合生成J____________。 5.某无色溶液,其中可能存在Na+,Ag+,Ba2+,Al3+,AlO2-,S2-,CO32-SO32-,SO42-。取该溶液进行有关实验,实验结果如图4所示。
(1)生成沉淀甲的离子方程式为____________。 | ||||||||||||||||||||||||||||||
| 考点与练习(之二) | ||||||||||||||||||||||||||||||
| 三、物质结构
(1)臭氧与氧气的关系是___________。
(1)X元素单质的化学式是___________。
以上所涉及元素均为短周期元素,据此推断:
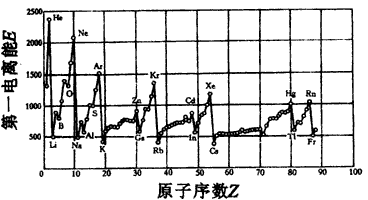
(1)同主族内不同元素的E值变化的特点是:___________;各主族中E值的这种变化特点体现了元素性质的___________变化规律。
计算:
3.把一定量的FeS放入100mL2.0mol·L-1的盐酸中,以制备H2S。FeS完全溶解后,共收集到1.10LH2S气体(标准状况),溶液中H2S的浓度为0.01mol·L-1。假定溶液的体积不变,试计算反应后溶液中Fe2+和H+的物质的量浓度。
| ||||||||||||||||||||||||||||||
| 考点与练习(之三) | ||||||||||||||||||||||||||||||
| 六、化学反应速率和化学平衡
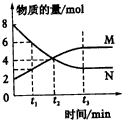
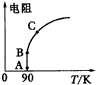
A.反应的化学方程式为:2M
A.T1<T2,p1>p2,m+n>p,Q<0
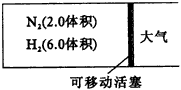
N2+3H2
2SO2+O2
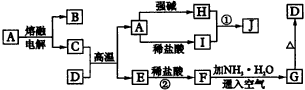
(1)指出A、B、C是(或可能是)什么溶液(写溶质式)__________。
现取4.00×10-2gYBa2Cu3O7-x样品,用稀盐酸溶解,在氩气保护下加入1.00gKI固体充分反应,Cu2+、Cu3+均转化为CuI,用0.0100mol·L-1Na2S2O3溶液滴定反应中生成的I2,在滴定终点时消耗0.0100mol·L-1的Na2S2O3溶液18.14mL。填空并回答: | ||||||||||||||||||||||||||||||
| 考点与练习(之四) | ||||||||||||||||||||||||||||||
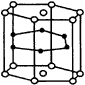
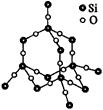
| 十、晶体
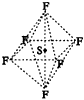
2.SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如图17所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为( )。
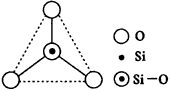
A.键角为120° B.化学组成为SiO32-
A.MgB B.Mg3B2 C.Mg2B D.Mg2B2
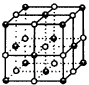
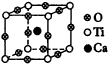
6.图21为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(1)B的分子式为___________。
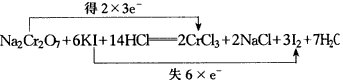
3.根据可逆反应:AsO43-+2I-+2H+
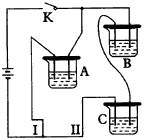
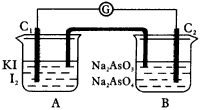
(1)向A溶液中逐滴加入浓HCl,发现电流计指针发生偏转。
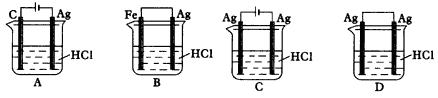
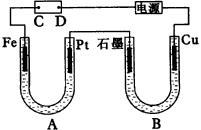
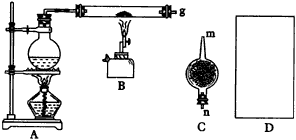
2.(1)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图26所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
a极材料为___________。
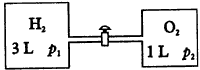
(1)A中发生反应的化学方程式为___________。
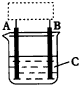
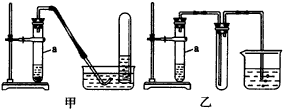
(1)甲管内加的A是一种___________,其中进行的反应是___________。 | ||||||||||||||||||||||||||||||
| 考点与练习(之五) | ||||||||||||||||||||||||||||||
| Ⅱ.无机化合物
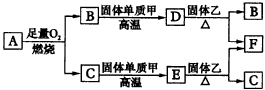
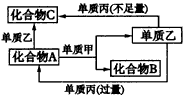
根据图中关系:
填写下列空白:
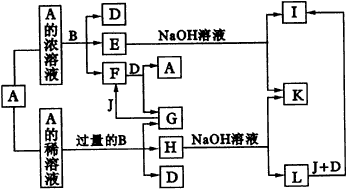
试回答下列问题:
已知E溶液与石炭酸的稀溶液混合时,溶液呈紫色。请回答:
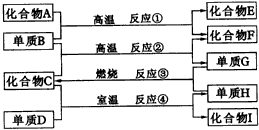
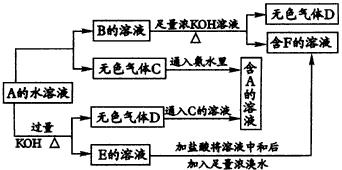
已知:A、B、C、D、E、F六种物质中均含有同一种元素;G为主族元素的固态氧化物。
请回答下列问题:
(1)化合物E与水反应生成白色浆状物;
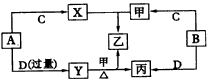
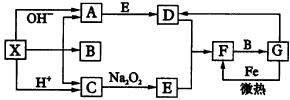
试确定A、B、C、D、X各代表什么溶液。
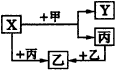
(1)若甲是具有还原性单质,X、Y、Z中只有一种是离子晶体,则:
试回答以下问题:
(1)写出各物质的化学式:
已知,开始生成氢氧化物沉淀到沉淀完全的pH范围分别是Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8,试回答以下问题:
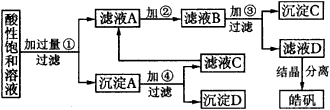
依据下述流程,完成下列填空: | ||||||||||||||||||||||||||||||
| 考点与练习(之六) | ||||||||||||||||||||||||||||||
| Ⅲ.有机化学
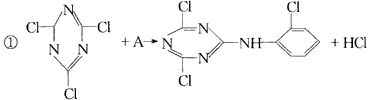
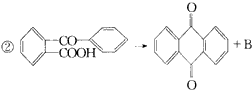
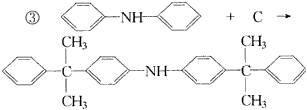
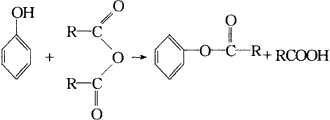
反应①的类型是____________,反应②类型是____________,反应③类型是____________。
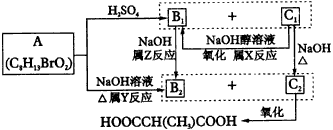
(1)B2、C1分别属于下列哪一类化合物?
产物不稳定,受热即脱水而生成不饱和醛。
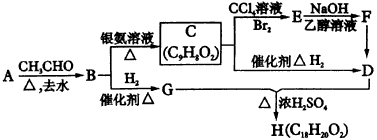
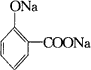
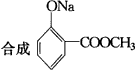
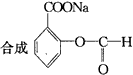
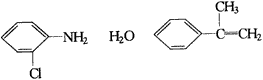
物质B是一种可以作为药物的芳香族化合物,请根据图44(所有无机产物均已略去)中各有机物的转变关系回答问题。
(1)写出B、F的结构简式B____________,F____________。
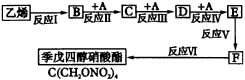
现以乙烯为初始原料,按图45指定步骤制备季戊四醇硝酸酯。参加下列反应的A物质在常温下是一种无色、有强烈刺激性气味的气体,易溶于水,其水溶液具有杀菌和防腐能力,可用来浸制生物标本。
(1)写出下列反应方程式(注明反应条件并配平):
请用计算、推理,填写以下空白。
请选择必要的其他反应物,用最佳途径合成下列有机物,写出反应的化学方程式:
(1)①____________,②____________,③____________。 (2)①____________,②____________。 | ||||||||||||||||||||||||||||||
| 考点与练习(之七) | ||||||||||||||||||||||||||||||
| Ⅳ.化学实验
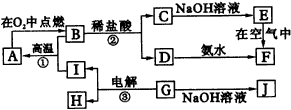
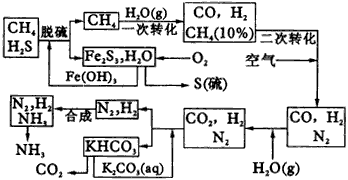
回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式___________。
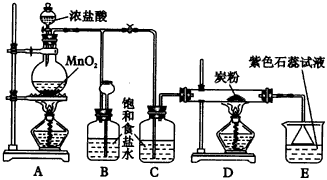
(1)A是氯气发生装置,其中发生反应的离子方程式为___________。
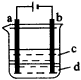
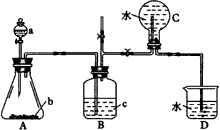
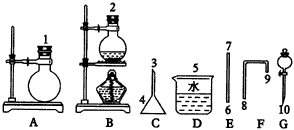
(1)利用___________仪器可作为制溴单质的装置(填仪器代号,下同),制取反应方程式为___________。
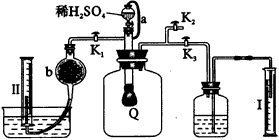
(1)Q内发生反应生成___________种气体,其中的反应有___________个氧化还原反应。 | ||||||||||||||||||||||||||||||
| 考点与练习(之八) | ||||||||||||||||||||||||||||||
| 参考答案
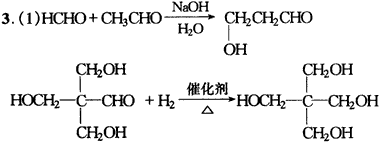
4.(1)①②③④⑤,这些反应有单质参加或有单质生成。(2)H2O2,SO2,H2S
(3)砷两Z元素位于周期表中金属与非金属元素的分界线附近
(3)C+H2O
2Mg+CO2
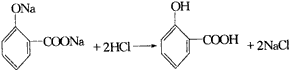
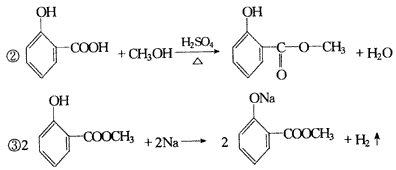
Ⅲ.有机化学
二、有机反应
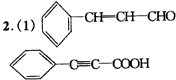
(2)①②③④⑤⑦
(4)5
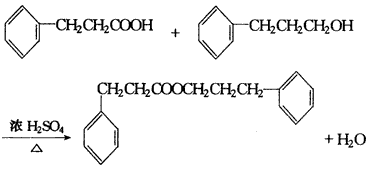
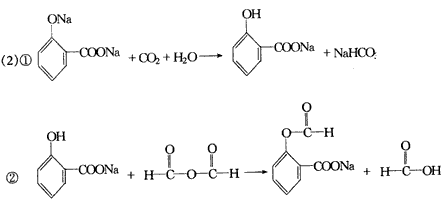
(2)氧化反应加成反应还原(加成)反应酯化反应
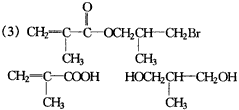
(3)CH3CH2COOCH(CH3)2
Ⅳ.化学实验 |