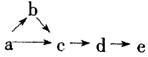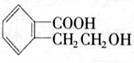高三化学第二学期期初目标检测
高 三 化 学
可能用到的原子量:H—1 C—12 N—14 Na—23 S—32 Ca—40
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.发射宇宙飞船的运载火箭的推进剂引燃后,产生大量高温气体从尾部喷出,该气体主要
成分是CO2、H2O、N2、NO等,在发射现场可看到火箭尾部产生大量红色气体,其原因
是 ( )
A.高温下N2遇空气生成NO2 B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2 D.NO与H2O反应生成H2和NO2
2.自来水用适量氯气杀菌消毒。不法商贩用自来水冒充纯净水谋取暴利,可用化学试剂辨
别真伪,该试剂可以是 ( )
A.酚酞试液 B.氯化钡溶液 C.氢氧化钠溶液 D.硝酸银溶液
3.某主族元素的最高价含氧酸的阴离子的符号是RO3-,则该元素的气态氢化物的化学式是
( )
A.HR B.H2R C.RH3 D.RH4
4.下列各离子化合物中,阳离子与阴离子的半径之比最小的是 ( )
A.KCl B.NaBr C.LiI D.KF
5.美国夏威夷联合天文中心的科学家发现了新氢微粒,该微粒是由3个氢原子核(只含质
子)和2个电子构成,关于这种微粒的下列说法中正确的是 ( )
A.是氢元素的一种新的同素异形体 B.是氢元素的一种新的同位素
C.该微粒的组成可用H3表示 D.该微粒比普通氢分子多一个氢原子核
6.将各0.05mol的下列物质置于500mL水中充分搅拌后,溶液中阴离子数目最多的是( )
A.NH4Br B.K2SO4 C.Mg(OH)2 D.Na2S
7.下列关于非金属元素的叙述中,正确的是 ( )
A.周期表中各主族所含元素不一一窍不通都有非金属元素
B.非金属元素的原子都易得电子生成相应的阴离子
C.只由非金属元素组成的晶体一定是分子晶体
D.非金属元素原子的最外层电子数都大于或等于4
8.一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3搅拌后静止,最终所
得晶体的质量是 ( )
A.等于1.06g B.大于1.06g而小于2.86g
C.等于2.86g D.大于2.86g
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列实验室中分离或除杂质的方法中不正确的是 ( )
A.用升华法分离碘和碘化钠固体混合物
B.用加热法除去氯化钙中混有的氯化氨
C.用蒸馏法分离乙醇和丁醇混合物
D.用萃取法除去溴苯中混有的溴单质
10.下列事实中,能说明氯的非金属性比硫强的是 ( )
A.高氯酸的酸性比硫酸强
B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫比氢的热稳定性好
D.氯原子的最外层电子数比硫原子最外层电子数多
11.设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A.1L 0.1mol/L的醋酸溶液中含离子和分子总数为NA
B.22.4L氖气中所含氖原子数为NA
C.1.6gNH2-离子中所含电子数为NA
D.2g D2O中所含中子数为NA
12.把0.6mol气体X和0.4mol气体Y混合于2.0L的密闭容器中,发生如下反应:
![]() 3X(气)+Y(气) nZ(气)+2W(气)测得5min末已生成0.2molW,又知以Z
3X(气)+Y(气) nZ(气)+2W(气)测得5min末已生成0.2molW,又知以Z
表示的平均反应速率为0.01mol/L(L·min),则n值是 ( )
A.1 B.2 C.3 D.4
13.有M、R两种主族元素,已知M2-离子与R+离子核外电子数之和为20,下列说法正确
的是 ( )
A.M与R的质子数之和一定等于19
B.若M在第3周期,则R一定在第2周期
C.M2-可能比R+的离子半径小
D.M与R的原子序数之差可能等于7
14.A、B、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生下图所示转化,
其中a是单质;b在通常状况下是气体;c、d都是氧化物;e是该元素的最高价氧化物
|
A.Cl2 B.N2
C.S D.C
|
A.碳酸氢铵溶液与过量烧碱溶液共热:NH4++OH- NH3↑+H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HclO+HCO3-
C.小苏打溶液与石灰水混合:HCO3-+OH-=CO32-+H2O
D.氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
![]() 16.在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积
16.在一密闭容器中,反应aA(气) bB(气)达平衡后,保持温度不变,将容器体积
增加一倍,当达到新平衡时,B的浓度是原来的60%,则 ( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.化学计量数a>b
17.分子式为C4H8O3的有机物,一定条件下具有如下性质:①在浓硫酸存在下,能分别与
CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物
质,该物质只存在一种结构形式;③在浓硫酸存在下,能生成一种分子式为C4H6O2的
五元环状化合物。则C4H8O3的结构简式为 ( )
A.HOCH3COOCH2CH3 B.CH3CH(OH)CH2COOH
C.HOCH2CH2CH2COOH D.CH3CH2CH(OH)COOH
18.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx
与NaClO的物质的量之比为1:16,则x值是 ( )
A.2 B.3 C.4 D.5
|
三、(本题包括2小题,共21分)
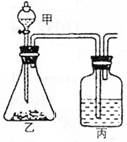
19.(10分)利用右图所示装置(暂不考虑尾气的吸收),选用中
学化学常见试剂设计两个实验,将所用试剂名称、丙中现象
及由此得出的实验结论(可以是单一物质的性质,也可以是
不同物质性质比较)填入下列空白处:
(1)[实验一]
所用试剂:甲 、乙 、丙
丙中现象:
实验结论:
(2)[实验二]
所用试剂:甲 、乙 、丙
丙中现象:
实验结论:
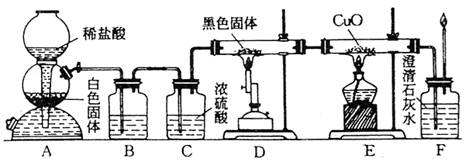
20.(11分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有
还原性。回答下列问题。
|
(1)写出装置A中所发生反应的离子方程式: 。
(2)装置B中最适宜的试剂的名称是 。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是
。
(4)实验后,有同学说“根据装置F中澄清石灰水变浑浊的现象也能确认一氧化碳具有
还原性”,你认为该说法是否成立,说明理由;若不成立,需要对图示装置做哪些
改进才可使该说法成立。
四、(本题包括2小题,共18分)
21.(8分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离
子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺
序关系中正确的是(选填序号) 。
(2)若上述关系中③是正确的,则溶液中溶质的化学式是 。
若上述关系中④是正确的,则溶液中溶质的化学式是 。
(3)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c
(HCl)(填“大小”、“小于”、或“等于”,下同) c(NH3·H2O),混合前盐酸中c(H+)和氨水中c(OH-)的关系c(H+) c(OH-)。
22.(10分)有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
|
②X、Z、W分别与Y都可组成两种中学常见化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2溶济。
(1)(3分)写出由Y与Z两元素形成化合物Z2Y2的电子
式 ,其化学键类型是 。
(2)(2分)写出2种均由这4种元素所组成的化合物在水
溶液中发生反应的离子方程式 。
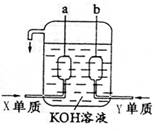
(3)(5分)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如右图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。
①a是电源的 极,电极反应式是 ;
②b电极上的电极反应式是 。
|
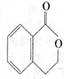
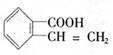
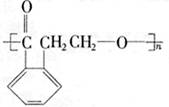
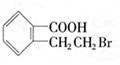
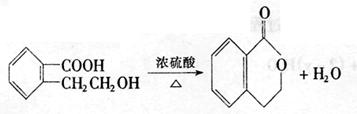
23.(11分)有机物A的结构简式是 ,它可以通过不同的反应得到
下列物质:
|
|
A. B.
| |||
| |||
C. D.
(1)A分子中含氧官能团的名称是 。
(2)写出制取B的化学反应方程式 。
(3)写出由A制取C、D、E三种物质的有机反应类型:C ;
D ;E 。
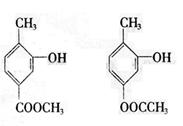
(4)写出两种既可看作酯类又可看作酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不相同):
; 。
高三化学参考答案
一、(每小题4分,共32分)
1.B 2.D 3.C 4.C 5.D 6.D 7.A 8.D
二、(每小题4分,共40分)
9.D 10.AC 11.AB 12.A 13.AB 14.BC 15.B 16.AC 17.C 18.D
三、(共21分)
19.(10分,每空1分)
合理答案均给分,部分参考答案下:
| 甲 | 乙 | 丙 | 丙中现象 | 结论 |
| 盐酸 | 石灰石 | 苯酚钠溶液 | 澄清溶液变浑浊 | 酸性:HC>H2CO3>C6H5OH |
| 浓盐酸 | 高锰酸钾 | 溴化钾溶液 | 无色溶液变橙色 | 氧化性:KMnO4>Cl2>Br2 |
| 浓硫酸 | 亚硫酸钠 | 品红溶液 | 红色溶液褪色 | SO2有漂白性 |
| 水 | 电石 | 溴水 | 橙色溶液褪色 | 乙炔分子含不饱和碳碳键 |
| 水 | 电石 | 高锰酸钾溶液 | 紫红色溶液褪色 | (同上) |
20.(11分)(1)(2分)CaCO3+2H+=Ca2++H2O+CO2↑
(2)(2分)饱和碳酸氢钠溶液
(3)(3分)没有除去气体中水蒸气,高温下水蒸气与碳反应生成H2和CO,H2也能还原CuO。
(4)(4分)不能成立。进入D的CO2不能完全转化成CO,剩余CO2也可使澄清石灰水变浑浊。在D、E之间增加一个盛有碱石灰的干燥的干燥管或U型管(也可在D、E之间增加两个洗气瓶,前一个盛NaOH溶液,后一个盛浓硫酸)。
四、(18分)
21.(8分)
(1)(2分)氯化铵①
(2)(4分)NH4Cl和NH3(或NH4Cl和NH3·H2O);NH4Cl和HCl
(3)(2分)小于;大于
![]() 22.(10分)
22.(10分)
![]() (1)(3分)Na+[:O:O:]2-Na+ 离子键、非极性共价键(或共价键)
(1)(3分)Na+[:O:O:]2-Na+ 离子键、非极性共价键(或共价键)
(2)(2分)H++HSO3-=H2O+SO2↑(写HSO4—+HSO3-=SO42-+H2O+SO2↑也给分)
|
五、(21分)
23.(11分)
(1)(2分)羧基、羟基
(2)(2分)
|
(4)(4分) (合理答案均给分)