高 三 化 学(第11周)
【高三化学第二学期期中考试试题】
原子量:H—1 C—12 O—16 Na—23 S—32 Cu—64 Ag—108 Ba—137
一、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意)
1、把氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,加热时如果观察到有红色沉淀生成,说明该尿液中含有( )
A、食醋 B、乙醇 C、葡萄糖 D、食盐
2、下列说法正确的是( )
A、电解稀盐酸和氯化钠饱和溶液,在两种情况下都会引起溶液中[OH-]的增大(设电解前后温度不变)
![]() B、在分子CH3— —CH3中,在同一条直线上的碳原子最多有4个
B、在分子CH3— —CH3中,在同一条直线上的碳原子最多有4个
C、空气中的飘尘不能催化二氧化硫的氧化
D、久置的氧化铝易与强酸和强碱反应
3、已知:C60分子在一定条件下可与F2反应生成C60F60,则在C60晶体存在的化学键有( )
(1)离子键;(2)非极性键;(3)极性键;(4)范德华力;(5)不饱和键
A、(1)(2)(5) B、(2)(4)(5) C、(2)(3)(4) D、(2)(5)
4、设某元素一个原子的核内质子数为m,中子数为n,则下列论断正确的是( )
A、这种元素的相对原子质量为(m+n)
B、不能由此确定该元素的相对原子质量
C、设一个碳原子质为wg,则该原子的相对原子质量为12(m+n)/w
D、该原子的摩尔质量为(m+n)g
5、实验室将NaClO3和Na2SO3按物质的量比2:1倒入烧瓶中,同时滴入稀硫酸,产生棕黄色的气体X,反应后测得NaClO3与Na2SO3恰好完全反应,则X的化学式为( )
A、Cl2 B、Cl2O C、ClO2 D、Cl2O3
二、选择题:(本题包括12小题,每小题3分,共36分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括2个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
6、将下列固体在隔绝空气的密闭器中用酒精灯加热,在加热过程中发生了化学反应,但冷却后又聚集为原来物质的是( )
A、碘片 B、氯化铵 C、碘化铵 D、碳酸钠
7、某短周期元素X的最高价氧化物的水化物的分子式为H2XOn,气态氢化物的分子式为![]() ,在下列说法中,不正确的是( )
,在下列说法中,不正确的是( )
A、H2XOn不稳定,易分解
B、![]() 的水溶液能使石蕊试液变为浅红色
的水溶液能使石蕊试液变为浅红色
C、可用H2XOn与有关物质作用制取![]()
D、![]() 和H2XOn,不能发生反应
和H2XOn,不能发生反应
8、设NA代表阿伏加德罗常数,下列说法正确的是( )
A、1molCu与过量硫加热充分反应,铜失去的电子数为2NA
B、将标况下22.4L的SO2和11.2L的O2混合在一密闭容器中,在一定条件下反应,得到的气体分子数为NA个
C、设金刚石晶体中碳原子数为NA个,则晶体中碳碳键数为2NA
D、一定量的氢氧化钠溶液与足量铝反应,每产生1mol氢气,铝便失去2NA个电子
![]()
![]()
![]() 9、已知2 —CHO+OH-→ —COO-+ —CH2OH,关于该反应,下列说法正确的是( )
9、已知2 —CHO+OH-→ —COO-+ —CH2OH,关于该反应,下列说法正确的是( )
A、OH-的主要作用只是中和了酸,使反应右移,而不起催化剂的作用
B、该反应实质上是碱催化下的歧化反应
C、加入过量OH-,产物都将转变成钠盐
D、因产物中有酸根离子和醇,且有碱做催化剂,所以该反应实际上是酯的水解
10、氯酸钾和二氧化锰混合加热充分反应后冷却,在残留物中加入浓H2SO4并加热,产生的气体是( )
A、只有O2 B、只有SO2 C、Cl2和HCl D、只有HCl
![]() 11、对可逆反应:N2+3H2 2NH3达平衡时,若分别增大压强和降低压强,两种情况下,对平衡体系正逆反应速率影响较大的依次是( )
11、对可逆反应:N2+3H2 2NH3达平衡时,若分别增大压强和降低压强,两种情况下,对平衡体系正逆反应速率影响较大的依次是( )
A、正反应速率,正反应速率 B、逆反应速率,逆反应速率
C、正反应速率,逆反应速率 D、逆反应速率,正反应速率
12、下列叙述错误的是( )
A、各类油脂熔点不同主要是由于各类油脂中所含的饱和烃基和不饱和烃基相对量的不同
B、乙醛是有机合成工业中的重要原料,它主要用来生产乙酸、丁醇等
C、向盛有氟化钠固体的烧瓶中加入浓H2SO4并加热,可制备HF
D、氯化钠溶液、水、葡萄糖溶液,这三种分散系均不能产生丁达尔现象
13、下列各物质的熔点按由低到高的顺序排列是( )
A、石墨、金刚石、晶体硅 B、钾、钠、镁
C、冰、干冰、冰晶石 D、晶体硅、硅铝合金、铝
14、下列各组离子混合时不一定有沉淀产生的是( )
A、Ag+、OH-、Cl-、NH4+ B、AlO2-、CO32-、K+、H+
C、Al3+、Fe3+、S2-、H+ D、H2PO4-、Ca2+、OH、Na+
15、用密度为Dg/cm3,质量分数为n%的浓HCl,配制成体积比为1:4稀HCl(稀HCl的密度为dg/cm3),则所配溶液的物质的量浓度为( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
16、下列离子方程式书写正确的是( )
A、将NaHSO4溶液滴加到有甲基橙试液的Ba(OH)2溶液中至溶液颜色由黄色变为橙色:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B、常温下向碳酸氢溶液中加入少量NaOH溶液:HCO3-+OH-=CO32-+H2O
C、过量铁与稀HNO3反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D、少量碳酸钙溶于FeCl3溶液:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
17、Na2CO3和NaHCO3组成的混合物与一定量的盐酸恰好完全反应,由下列数据不能求出混合物中Na2CO3质量分数的是( )
A、消耗HCl物质的量和生成水的质量
B、混合物的质量和生成CO2的物质的量
C、混合物的物质的量和生成NaCl物质的量
D、混合物的物质的量和生成CO2的质量
三、选择题:(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
18、室温下,PH=a的CH3COOH与PH=b的NH3·H2O等体积混合,恰好完全反应,设CH3OOH与NH3·H2O的电离度分别为:m%、n%,则m与n的关系正确的是( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
![]() 19、反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是( )
19、反应:xA(气)+yB(气) zC(气),达到平衡时测得A气体的浓度为0.5mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3mol/L,则下列叙述正确的是( )
A、x+y<z B、平衡向右移动
C、B的转化率升高 D、C的体积分数降低
20、加热25gA、5gB、10gC的混合物,使之充分反应,所得混合物中含有10gA、21gC,还有另一种物质D,假设A、B、C、D代表反应物或生成物的化学式,并令它们的式量依次是30、20、44、18,则反应的化学方程式是( )
A、2A+B=C+2D B、A+2B=2C+D
C、2A+B=2C+D D、A+2B=C+2D
21、用惰性电极和串联电路电解下列物质的水溶液:(1)NaCl;(2)NaNO3;(3)CuCl2;(4)AgNO3,在相同时间内生成气体的总体积(同温同压下测定),理论上由多到少的顺序是( )
A、(1)(2)(3)(4) B、(4)(1)(2)(3) C、(2)(1)(3)(4) D、(1)(2)(4)(3)
22、某物质的分子组成为CxHyOz,取该物质mg在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2固体中,充分反应后,若Na2O2固体的质量也增加mg,则该物质分子组成中必须有( )
A、x=y=z B、x=y C、y=z D、x=z
23、60℃时,将450g某硫酸铜溶液恒温蒸发掉310g水后,溶液恰好饱和,此温度下另取45g该CuSO4溶液,加入25g胆矾,完全溶解后溶液亦恰好饱和,则60℃时,CuSO4的溶解度为( )
A、62.5g B、51.6g C、40.0g D、29.6g
24、14gCu、Ag合金与足量某浓度的硝酸反应,将放出的气体与1.12L(标况O2)混合,恰好被水能合部吸收生成硝酸,则合金中Cu的质量为( )
A、1.6g B、3.2g C、6.4g D、9.6g
25、烃分子或含有双键、三键或环,其碳原子数所结合的氢原子数,则少于同碳原子数对应烷烃所全氢原子数,亦具有一定的不饱和度(用Ω表示),下表列出了几种烃的不饱和度:
|
| CH2=CH2 | CHºCH | ||
| Ω | 1 | 2 | 1 | 4 |
据此,下列说法不正确的是( )
A、1molΩ=3的不饱和链烃再结合6molH,即达饱和
B、C4H8的不饱和度与C3H6、C2H4的不饱和度可能相同,也可能不同
![]()
![]() C、 —CºC— 的Ω值等于7
C、 —CºC— 的Ω值等于7
D、CH3CH2CH=CH2与环丁烷的不饱和度相同
四、实验题:(本题包括2小题,共17分)
26、(7分)(1)A—D是中学化学实验中几种常见的气体发生装置示意图,请在①—⑦中选出制备气体的适宜装置,把编号填入A—D下边的空格中(多选要倒扣分)
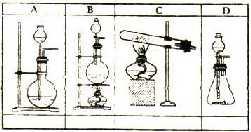 ①把浓H2SO4(70%)与Na2SO3微热制SO2;
①把浓H2SO4(70%)与Na2SO3微热制SO2;
②电石与水反应制乙炔;
③Zn与稀H2SO4反应制氢气;
④实验室制CH4;
⑤苯与浓H2SO4、浓HNO3混合酸反应制硝基苯;
⑥H2在Cl2中燃烧制HCl;
⑦赤热焦炭与高温水蒸气反应制水煤气。
 (2)某同学在制备溴苯时,他首先向圆底烧瓶中加入一定量的苯,然后他用滴管从保存溴的试剂瓶中上部取出了一定量的液体又加入烧瓶中,最后他向烧瓶中加入了适量的还原铁粉,结果他没有看到预期的实验现象,其原因是___________________________
(2)某同学在制备溴苯时,他首先向圆底烧瓶中加入一定量的苯,然后他用滴管从保存溴的试剂瓶中上部取出了一定量的液体又加入烧瓶中,最后他向烧瓶中加入了适量的还原铁粉,结果他没有看到预期的实验现象,其原因是___________________________
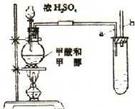
27、(10分)已知甲酸(HCOOH)是羧酸中最简单的一种,它具有羧酸的性质,在实验室里常用甲酸在浓H2SO4的催化作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有发生酯化反应的性质,装置如下图所示。
回答下列问题:
(1)制取甲酸甲酯反应的方程式为________________________________________
烧瓶中最可能发生的副反应为_________________________________________
(2)实验过程中选用的试剂及用品有:浓H2SO4、甲醇、甲酸还有________、_________两种物质。
(3)导管a不插入液面下的理由是______________________________________
长导管b的作用是_______________________________________________
在实验过程中导管b能否直接与大气相通,说明理由____________________
(4)大试管中溶液的作用有溶解甲醇,吸收甲酸,还有______________________________
(5)若大试管中溶液是氢氧化钠溶液,则收集到产物比预期的少,其原因是_____________
五、(本题包括3小题,共17分)
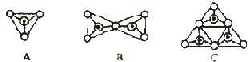 28、(5分)原硅酸根(SiO44-)中的硅原子被4个氧原子所包围,所以用图A来表示SiO44-的空间构型为____________,图B表示___________(写化学式)的空间构型,图C表示_______________(用化学式)的空间构型。
28、(5分)原硅酸根(SiO44-)中的硅原子被4个氧原子所包围,所以用图A来表示SiO44-的空间构型为____________,图B表示___________(写化学式)的空间构型,图C表示_______________(用化学式)的空间构型。
○:氧原子
●:硅原子
⊙:Si—O
29、(6分)长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对次氟酸的研究引起充分重视。
(1)制备次氟酸的反应式______________________________
次氟酸的电子式为________________________________
(2)次氟酸能与水反应得溶液A,A中含B、C两种溶质,B是一种极难被氧化的物质,C既有氧化性又有还原性,写出次氟酸与水反应的化学方程式
_____________________________________________________________________
(3)将溶液A滴入紫红色酸性高锰酸钾溶液中,紫红色褪去,有Mn2+生成,写出这一反应的离子方程式______________________________________________
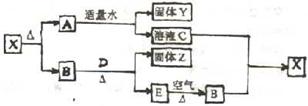 30、(6分)已知X是一种常见的白色固体,D、E是两种常见的固体单质,B是常见气体,现有如下转化关系:
30、(6分)已知X是一种常见的白色固体,D、E是两种常见的固体单质,B是常见气体,现有如下转化关系:
回答下列问题:
(1)写出X、Y的化学式:X________________Y________________
(2)B与D加热时发生反应的反应式为_________________________________
(3)过量B与溶液C发生反应的离子方程式为_______________________________
六、(本题包括3小题,共18分)
31、(6分)在烃的分子结构中,若每减少2个氢原子,则碳碳间便增加一对共用电子,已知分子组成为CnH2n+2的烃分子中碳碳间的共用电子对数为(n-1),则分子式为CnH2n-2的烃分子中,碳碳间的共用电子对数为_____________;CX也可以看作烃减氢后的产物,则C60分子中碳碳间的共用电子对数为_______________;若某烃的分子式为CxHy,且知该烃分子中碳碳间共用电子对数为140,则x和y之间满足的关系为____________
32、(6分)化合物A,学名邻羟基苯甲酸,俗名水杨酸,其结构为:
![]() —OH
—OH
—COOH
(1)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有________(填写数字)种,其结构简式分别为__________________________
(2)水杨酸的同分异构体中,属于酚类,但是不属于酯类,也不属于羧酸类的化合物必定含有_________基(填写除了羟基以外的官能团名称)
33、(6分)1mol某饱和烃的含氧衍生物A与2molNaOH在一定条件下恰好完全作用生成1mol钠盐,A的相对分子质量不超过120,氧的质量分数不超过0.543,试回答下列问题:
(1)A的1个分子中含有_________个氧原子;
(2)A的化学式为_______________,
(3)A有多种同分异构体,其中有一种不能使石蕊试液变红,写出这种异构体与氢氧化钠溶液共热的化学方程式_____________________________________________
七、(本题包括2小题,共15分)
34、(6分)有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量BaCl2溶液可得白色沉淀9.32g,另取10mL这种溶液与4mol/L的NaOH溶液25mL恰好完全中和。
(1)混合溶液中,H2SO4和HNO3的物质的量浓度各是多少?
(2)再取10mL混和液与0.96g铜粉共热,将有多少mL气体产生(标准状况)?
35、(9分)将amolH2S与一定量O2在一容积可变的密闭容器中混合点燃反应完毕后,已知O2无剩余,恢复至反应前的状况(1.01×105Pa,120℃)气体体积是反应前的b%,
(1)若b=70时,写出点燃后表示反应前后体积关系的化学方程式:
___________________________________________________
(2)b的取值范围:________________________
(3)若70≤b≤80,设参加反应的O2物质的量为mmol,则m的取值范围为_____________
(4)若燃烧后平均相对分子质量为26,参加反应的O2为mmol,则m值可能___________。
【高三化学试题答案】
一、二、三题
1、C 2、A 3、D 4、B 5、C 6、B 7、AD 8、CD 9、B
10、C 11、A 12、CD 13、B 14、AB 15、C 16、BC 17、D
18、A 19、D 20、A 21、A 22、D 23、C 24、B 25、B
四、26、(1)A③ B① C④ D②③
(2)中上部是溴水
浓H2SO4
![]() 27、(1)HCOOH+CH3OH
HCOOCH3+H2O
27、(1)HCOOH+CH3OH
HCOOCH3+H2O
浓H2SO4 △
![]() HCOOH
CO↑+H2O
HCOOH
CO↑+H2O
△
(2)饱和Na2CO3溶液、碎瓷片(或沸石)
(3)防止受热不均匀引起倒吸、兼起冷凝器作用、不能,因生产CO、CH3OH污染大气
(4)减小酯的溶解度 (5)酯在强碱性条件下水解
五、28、正四面体、Si2O76-、Si3O96-
![]() 29、(1)F2+H2O=HF+HFO H:O:F:
29、(1)F2+H2O=HF+HFO H:O:F:
(2)HFO+H2O=HF+H2O2
(3)2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
![]() 30、(1)X:CaCO3 Y:Ca(OH)2
(2)CO2+2Mg 点燃 2MgO+C
30、(1)X:CaCO3 Y:Ca(OH)2
(2)CO2+2Mg 点燃 2MgO+C
(3)CO2+OH-=HCO3-
六、31、n+1 120 4x-y=280
![]()
![]()
![]()
![]()
![]() OH
O OH O OH
OH
O OH O OH
![]()
![]()
![]() 32、(1)3种 —O—C—H —O—C—H
32、(1)3种 —O—C—H —O—C—H
![]()
![]() O—C—H
O—C—H
O
![]()
![]() (2)醛
O O
COONa
(2)醛
O O
COONa
![]()
![]() 33、(1)4 (2)CH2O (3)CH3—O—C—C—O—CH3+2NaOH △ COONa
+2CH3OH
33、(1)4 (2)CH2O (3)CH3—O—C—C—O—CH3+2NaOH △ COONa
+2CH3OH
34、![]()
35、(1)6H2S+4O2=5S+SO2+6H2O
(2)66.7%≤B≤100%
(3)![]() ≤
≤![]()
![]() ≤m≤
≤m≤![]()
(4)m=![]() 或m=
或m=![]()