高三化学第一次统考试题
化 学
可能用到的原子量:H-1 Cl-35.5 Br-80 I-127 S-32 O-16 Cu-64
Fe-56 K-39 Na-23 Mg-24 Al-27 C-12
第一卷(60分)
一、选择题(每小题只有一个正确答案,8小题共24分)
1、下列有关叙述错误的是
A、甲状腺肿大的病人宜多食海带 B、碘化银和干冰常用于人工降雨
C、利用升华法可分离碘和氯化铵的混合物 D、I-不能使淀粉溶液变蓝
2、下列有关说法中错误的是
A、不能用甘油萃取碘水中的碘 B、萃取与分液时常用仪器是分液漏斗
C、分液时上层液体应从上口倒出
D、CCl4与溴水充分振荡后在上层溶液中滴加AgNO3溶液时无沉淀产生。
3、用含HCl 146克的浓盐酸与87克MnO2混合共热充分反应,则下列说法中正确的是
A、固体全部溶解 B、标况下产生气体22.4L
C、反应中共转移2mol电子 D、HCl有剩余
4、下列说法中错误的是
A、漂白粉应隔绝空气密封保存 B、氯水保存在棕色广口瓶中
C、AgI、AgBr和浓硝酸等见光易分解的物质保存在棕色瓶中
D、氢氟酸与氟化钠溶液均应保存在塑料瓶中
5、下列叙述中正确的是
A、漂白粉溶液能使蓝色石蕊试纸先变红后褪色
B、漂白粉溶液具有漂白性是因为其中含有Ca(ClO)2
C、氯水能使有色布条褪色是因为Cl2与水反应生成的HClO具有强氧化性;
D、工业上制取漂白粉是用消石灰固体而不是用石灰水和氯气反应的。
6、在100mL0.1mol/LAgNO3溶液中加入100mL溶有0.01molBaCl2的溶液,再加入100mL溶有0.01molCuSO4·5H2O的溶液,充分反应。下列说法正确的是
A、最终得到白色沉淀和无色溶液;
B、最终得到的白色沉淀是等物质的量的两种化合物的混合物;
C、在最终得到的溶液中,Cl-的物质的量为0.02mol;
D、在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol/L。
7、设NA为阿佛加德罗常数,则下列说法中正确的是
A、常温常压下,1.8gNH4+中含有电子数为NA
B、同温同压下,相同体积的任何气体单质均具有相同的原子个数;
C、2L1mol/LAl2(SO4)3溶液中含有4NA个Al3+
D、标况下,22.4LSO3中含有的原子总数为4NA个。
8、常温时,下列反应都能右向进行:2W- + X2 = 2X- + W2,2Y- + W2 = 2W- + Y2,2X- + Z2 = 2Z- + X2,由此可知:
A、X-、Y-、Z-、W-中Z- 还原性最强 B、还原性:X- > Y-
C、2Z- + Y2 = Z2 + 2Y-不能右向进行 D、X2、Y2、Z2中以Z2的氧化性最弱
二、选择题(每小题有1~2个正确答案,9小题共36分)
9、下列各组离子在强碱性溶液中可以大量共存的是
A、Ba2+、Na+、Cl-、ClO-、NO3- B、NH4+、Ba2+、NO3-、Cl-
C、AlO2-、S2-、ClO-、Na+、K+ D、SO32-、S2O32-、Fe3+、K+
10、下列离子方程式书写正确的是
A、Cl2充入澄清石灰水中: Cl2 + 2OH- = Cl- + ClO- + H2O
B、SO2充入少量氨水中: SO2 + NH3·H2O = NH4+ + HSO3-
C、稀硫酸中滴加少量Ba(OH)2溶液: Ba2+ + H+ + OH- + SO42- = BaSO4↓+ H2O
D、大理石与醋酸反应: CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
11、下列叙述中正确的是:
A、阳离子只有氧化性,阴离子只有还原性;
B、失电子越多,其还原性就越强;
C、有单质生成的反应不一定是氧化还原反应;
D、含最高价元素的化合物,一定具有强氧化性
12、依阿佛加德罗定律,下列叙述中正确的是
A、同温同压下,两气体的体积之比等于摩尔质量之比;
B、同温同压下,两种气体的物质的量之比等于密度之比;
C、同温同压下,两气体的摩尔质量之比等于密度之比;
D、同温同体积时,两气体的物质的量之比等于其压强之比。
13、有13.5g不纯的氯化铜粉末(内含一种杂质),当它与足量AgNO3溶液反应时,生成29gAgCl沉淀,则粉末中的杂质不可能是
A、AlCl3 B、CaCl2 C、NH4Cl D、BaCl2
14、标况下,将V升A气体(式量为M)溶于0.1L水中,所得溶液密度为d g/cm3,则此溶液物质的量浓度的表达式为:
|
|
|
|
![]()
![]()
![]()
![]() A、
B、
C、
D、
A、
B、
C、
D、
15、体积为V升,密度为d g/cm3的某溶液中,含有摩尔质量为M g/mol的溶质的质量是m克。若此溶液中溶质的物质的量浓度为c mol/L,溶质的质量分数为w,则下列各表示式中正确的是
|
|
|
|
![]()
![]()
![]() A、c =
B、c =
C、c =
D、c =
A、c =
B、c =
C、c =
D、c =
16、在水溶液中,YO3n-和S2-发生的离子反应如下:YO3n- + 3S2- + 6H+ = Y- + 3S↓+3H2O
则YO3n-中Y元素的化合价和原子最外层电子数分别为:
A、+4 、6 B、+7 、7 C、+5、 7 D、+5、5
17、将含a molNa2S的溶液和含b molNa2S2O3的溶液混合,然后加硫酸酸化,酸化后的溶液无任何气体逸出,若测得此时溶液呈中性,则a:b为:
A、2:1 B、2:3 C、1:2 D、1:3
第二卷(共90分)
三、实验题(本题包括3小题,共24分)
18、(4分)在一烧杯中盛有100mL2mol/L的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示)。向该烧杯里缓缓加入0.4mol/LBa(OH)2溶液至恰好完全反应,在此实验过程中
 (1)烧杯里观察到的现象有:
(1)烧杯里观察到的现象有:
① (1分)
② (1分)
(2)写出反应过程式中的离子方程式:
。(2分)
19、(10分)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。试回答:
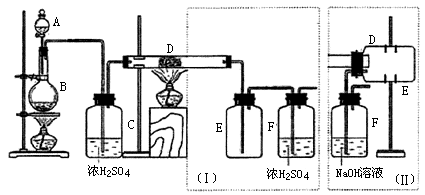
(1)B中反应的化学方程式为:____________________________________;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:______________________________________________________________。
(3)D中反应化学方程式为:_______________________________________。
(4)装置(I)的主要缺点是:____________________________________ 。
(5)装置(II)的主要缺点是:____________________________________。
如果选用此装置来完成实验,则必须采取的改进措施是:_________________________________________ __________________ _。
(以上各小题每小题2分)
20、(10分,每空2分)现实验室需用98%H2SO4 (d=1.84g/cm3)配制250mL
1.00mol/LH2SO4,则:
(1)需98%H2SO4 mL;
(2)需要的仪器是 、 、 、 、 ;
(3)如何检验容量瓶是否漏水?
。
(4)应选用的量筒的规格是 (填序号)
A、10mL B、25mL C、50mL D、100mL
(5)下列事项中会使所配溶液的物质的量浓度偏高的是 。(填序号)
A、定容时仰视刻度线; B、定容时府视刻度线; C、移液时有液体溅出; D、未洗涤烧杯和玻璃棒; E、移液时未等溶液冷却就注入容量瓶; F、容量瓶在移液前用1.00mol/LH2SO4润洗
四、填空题(本大题包括小题,共52分)
21、工业制硫酸中沸腾炉中的反应方程式为 ,其中氧化产物是 ,若反应中共转移2.2mol电子,则被硫元素还原的O2为 g。 (每空2分,共6分)
22、(8分)(1)在V LAl2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)Wg碳酸钠晶体(Na2CO3·10H2O),溶于VmL水中,测得所得溶液的密度为d g/mL,则此溶液中溶质的质量分数为 ,溶液中溶质的物质的量浓度为 。 (每空2分,共8分)
23、(6分)已知NaBiO3是黄色微溶于水的固体,Bi3+为无色,其硫酸盐易溶于水,将NaBiO3固体加入MnSO4和H2SO4的混合溶液中,加热,得紫色混合溶液,则:
(1)写出该反应的离子方程式 ;
(2)如将MnSO4改用MnCl2或将硫酸改用盐酸,则下列说法中可能的是
A、必定有黄绿色气体产生; B、必定无黄绿色气体产生;
C、溶液必定变成紫色; D、溶液可能不会变成紫色 (每空3分)
24、(8分)根据下图变化关系,回答问题:
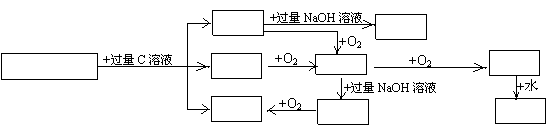
气体D A溶液
A、B混合溶液 沉淀E 气体X 气体Y
滤液F B溶液 C溶液
(1)气体D的分子式是 ,气体X的分子式是 ;(4分)
(2)A、B的混合溶液中,溶质A和B的物质的量n(A)和n(B)必须满足的条件是 ;(2分)
(3)生成沉淀E的离子方程式是 。
25、(6分)某无色溶液可能含有下列钠盐中的几种:A-NaCl ;B-Na2S;C-Na2SO3 ;D-Na2S2O3;E-Na2SO4;F-Na2CO3,向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清石灰水变混浊,不能使品红溶液褪色。则:
(1)不能使品红溶液褪色,说明该气体中不含 (填化学式);(2分)
(2)此无色溶液中至少存在哪几种钠盐?请写出全部的可能情况。(填序号4分)
① ② ③ ④ (不一定填满也可补充)
26、(18分)有一包含有AlCl3、MgCl2、NaBr三种物质的混合物粉末,按下列实验测定各成分的质量分数(已知氯化物在HCl气流中灼烧不会水解)
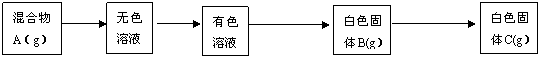 蒸馏水
通入足
蒸干后在HCl气
加蒸馏水溶解
蒸馏水
通入足
蒸干后在HCl气
加蒸馏水溶解
量X气体 流中灼烧冷却 加足量Y液过滤
(1)气体X是 ,溶液Y中的溶质是 ,最后的纯净物C是 。(6分)
(2)加入足量Y溶液的目的是
;过滤后,沉淀C必须用蒸馏水冲洗干净,其目的是 。(2分)
(3)写出B→C过程中的所有离子方程式:
。(4分)
(4)B→C过滤中滤液合格的标准是 ;若不合格,则必须进行的操作是 。(2分)
(5)原混合物中氯化铝的质量为 ;(2分)
(6)原混合物中溴化钠的质量分数为 。(2分)
五、计算题(本题包括2小题,共14分)
27、(6分)在标准状况下,在635mL水中需充入多少LHCl气体才能得到密度为1.18g/cm3,物质的量浓度为11.8mol/L的盐酸?
28、(8分)将1molH2S和a molO2置于一个容积可变的容器内进行反应,维持容器内气体的压强(101kPa)不变,在120℃下测得反应前后容器中气体的密度分别为d1和d2。若a的取值范围不同,则H2S的氧化产物可能有如下三种情况:
(1)全部是SO2,此时a的取值范围是 ;
(2)全部是S,此时a的取值范围是 ,且d1 d2(填>、<、=)
(3)部分是S,部分是SO2时,此时a的取值范围是 。反应所
生成的SO2的物质的量为 mol,容器内气体物质的量之和为
mol(用a的代数式表示)
班级 姓名 座号
请将选择题答案填入下表
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
最分131分,平均分84.5分。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| C | D | D | B | D | B | A | C | A | AB | C | CD | D | B | AD | C | A |
18、有白色沉淀产生;小球逐渐沉至烧杯底部;
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
![]() 19、(1)MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
19、(1)MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
(2)先加热B,使黄绿色气体充满装置后,再加热D。
![]() (3)2Fe + 3Cl2 == 2FeCl3
(3)2Fe + 3Cl2 == 2FeCl3
(4)E中进气管容易堵塞;余Cl2进入空气会产生污染。
(5)产品易受潮。在E和F之间连接一个盛有干燥剂的装置。
20、(1)13.6 (2)量筒、烧杯、250mL容量瓶、玻璃棒、胶头滴管; (3)向容量瓶中加适量水,塞好瓶塞,一手食指顶住活塞,另一只手托住瓶底,倒置,如不漏水,则放正后再旋转活塞180度,重复上述操作后不漏水则可使用。
|
21、4FeS2 + 11O2 === 2Fe2O3 + 8SO2 ; Fe2O3 、SO2; 16
22、a/54V mol/L; a/18V mol/L。
5300w/143(w+V) % ; 1000wd/286(w+v) mol/L
23、5NaBiO3 + 2Mn2+ + 14H+ = 5Na+ + 5Bi3+ + 2MnO4- + 7H2O ; AD
24、H2S ;SO2 ;n(A)>2n(B) ; 2S2- + SO32- +6H+ = 3S↓+3H2O
25、SO2 。 BFD ;BFC
26、(1) Cl2 ;NaOH(或KOH等);Mg(OH)2
(2)使Al3+充分转化成AlO2-;使Mg2+沉淀更完全。 除去吸附在Mg(OH)2固体表面的可溶性杂质。
(3)Al3+ + 4OH- = AlO2- + 2H2O ;Mg2+ + 2OH- = Mg(OH)2↓
(4)A-95C/58-206(A-B)/89 克;206(A-B)/89A ×100%
27、224L
28、≥ 1.5 。 ≤0.5 ; > 。 1.5 > a > 0.5 ;a - 0.5; a + 0.5