高考化学招生全国统一考试
化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,第I卷1至4页,第II卷5至10页,共150分。考试时间120分钟。
第I卷(选择题 共72分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试题卷上。
3.考试结束,监考人将本试卷和答题卡一并收回。
可能用到的原子量:H 1 C 12 N 14 O 16 S 32 Cl 35.5
Ca 40 Cu 64 Ag 108 Ba 137
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
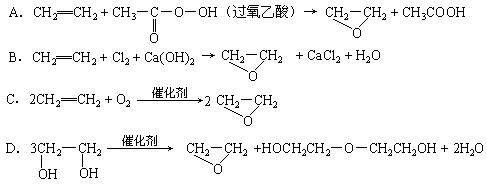
1.为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成份都是
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
2.下列过程中,不涉及化学变化的是
A.甘油加水作护肤剂
B.用明矾净化水
C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹
3.下列化合物中阴离子半径和阳离子半径之比最大的是
A.LiI B.NaBr C.KCl D.CsF
4.为了保护臭氧层,可采取的有效措施是
A.减少二氧化硫的排放量 B.减少含铅废气的排放量
C.减少氟氯代烃的排放量 D.减少二氧化碳的排放量
5.在含有酚酞的0.1 mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色
A. 变蓝色 B.变深 C.变浅 D.不变
6.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
7.b g某金属与足量的稀硫酸反应,生成该金属的三价正盐和a g氢气。则该金属的相对原子质量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.将 NO3-+Zn+OH-+H2O→NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A.2 B.4 C.6 D.8
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.压强变化不会使下列化学反应的平衡发生移动的是
A.H2(气)+ I2(气) ![]() 2HI(气)
B.3H2(气)+N2(气)
2HI(气)
B.3H2(气)+N2(气) ![]() 2NH3(气)
2NH3(气)
C.2SO2(气)+O2(气) ![]() 2SO3(气) D.C(固)+ CO2(气)
2SO3(气) D.C(固)+ CO2(气) ![]() 2CO(气)
2CO(气)
10.下列说法中错误的是
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
11.绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是
12.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确
选项
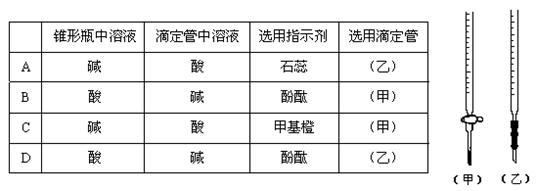
13.下列各组离子,在强碱性溶液中可以大量共存的是
A.I-、AlO2-、Cl-、S2-
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-
D.SO32-、NO3-、SO42-、HCO3-
14.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
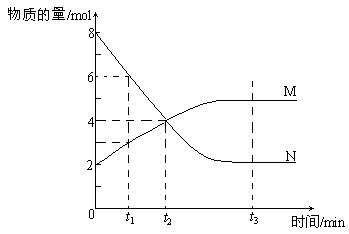
A.反应的化学方程式为:2 M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
15.某有机物X能发生水解反应,水解产物为Y和Z。同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是
A.乙酸丙酯 B.甲酸乙酯
C.乙酸甲酯 D.乙酸乙酯
16.在无土栽培中,需配制一定量含50 mol NH4Cl、16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A.2、64、24 B.64、2、24
C.32、50、12 D.16、50、24
17.在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4 · 5H2O的溶液,充分反应。下列说法中正确的是
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol/L
18.将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
2001年普通高等学校招生全国统一考试
化 学
第II卷(非选择题 共78分)
注意事项:1.第II卷共6页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
三.(本题包括2小题,共19分)
19.(6分)回答下面问题:
(1)分离沸点不同但又互溶的液体混合物,常用什么方法?
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
20.(13分)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
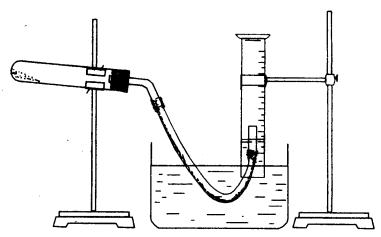
回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集到气体体积必须包括的几个步骤;①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:__________________________________(请填写步骤代号)
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
____________________________________________________________。
(4)如果实验中得到的氧气体积是c L(25 ℃、1.01×l05 Pa),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)= __________________________________________。
四.(本题包括2小题,共20分)
21.(10分)在120 ℃时分别进行如下四个反应:
A.2H2S+O2 ==2H2O+2S B.2H2S+3O2 ==2H2O+2SO2
C.C2H4+3O2==2H2O+2CO2 D.C4H8+6O2==4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和 p前> p后的是____________;符合关系式d前=d后和 p前= p后的是__________________(请填写反应的代号)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和 V前<V后的是____________;符合d前>d后和 V前>V后的是_________________(请填写反应的代号)。
22.(10分)下图每一方框中的字母代表一种反应物或生成物:
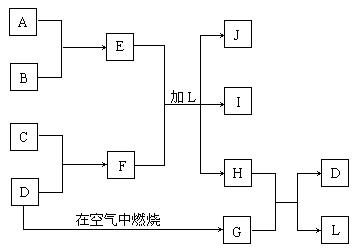
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:_________________。
(2)F的化学式为:______________。
(3)写出J受热分解反应的化学方程式:______________________________。
(4)H和G之间反应的化学方程式为:______________________________。
五.(本题包括2小题,共20分)
23.(12分)2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂。苯丙醇胺(英文缩写为PPA)结构简式如下:
![]()
其中φ代表苯基。苯丙醇胺是一种一取代苯,取代基是![]() 。
。
(1)PPA的分子式是:_______________________。
(2)它的取代基中有两个官能团,名称是_________基和________基(请填写汉字)。
(3)将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,其中5种的结构简式是:
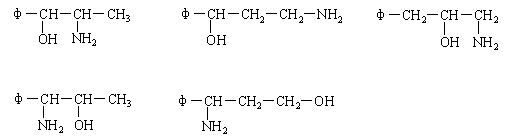
请写出另外4种同分异构体的结构简式(不要写出-OH和-NH2连在同一个碳原子上的异构体;写出多于4种的要扣分):
______________、______________、______________、______________。
24.(8分)某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为:
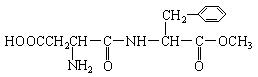
已知:①在一定条件下,羧酸酯或羧酸与含-NH2的化合物反应可以生成酰胺,如:
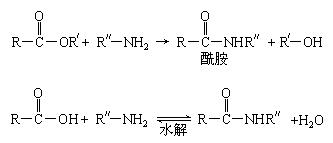
②酯比酰胺容易水解。
请填写下列空白:
(1)在稀酸条件下加热,化合物A首先生成的水解产物是:_________和__________。
(2)在较浓酸和长时间加热条件下,化合物 A可以水解生成:
_________________、 _________________________和__________________________。
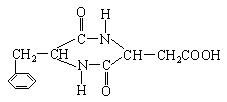
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和
_____________________________。(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
六.(本题包括2小题,共19分)
25.(7分)标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为
0.915 g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00 g/cm3计)
26.(12分)标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
高三学校招生全国统一考试
化学试题参考答案及评分标准
说明:
1.定出评分标准是为了使全国各地尽可能在统一标准下评定成绩,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的,同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2.化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3.化学方程式、离子方程式未配平的,都不给分。
一.(本题包括8小题,每小题4分,共32分)
1.B 2.A 3.A 4.C 5.C
6.B 7.C 8.C
二.(本题包括10小题,每小题4分,共40分)
9.A 10.A、D 11.C 12.C、D 13.A、C
14.D 15.A、B 16.B 17.B 18.C
三.(本题包括2小题,共19分)
19.(6分)
(1)蒸馏方法。(2分)
(2)取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,反之,则上层是水层。(4分)
20.(13分)
(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。(3分)
(2)②①③(3分)
(3)慢慢将量筒下移。(3分)
(4)![]() (4分)
(4分)
四.(本题包括2小题,共20分)
21.(10分)(1)B;C (各2分,共4分)
(2)D;A (各3分,共6分)
22.(10分)(1)H2O (2分)
(2)Na2S (2分)
(3)2Al(OH)3![]() Al2O3+3H2O (3分)
Al2O3+3H2O (3分)
(4)2 H2S+SO2==3S+2H2O (3分)
五.(本题包括2小题,共20分)
23.(12分)
(1)C9H13NO (2分)
(2)羟基、氨基 (2分)
(3)
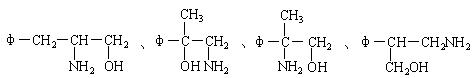
[每个2分,共8分。每多写一个倒扣2分,但第(3)题不出现负分]
24.(8分)
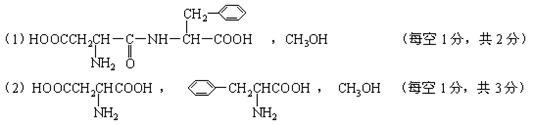
[注:(1)、(2)答案中的![]() ,在酸性条件下实为
,在酸性条件下实为![]() ,答案写
,答案写 ![]() 或
或![]() 均给分]
均给分]
(3)
六.(本题包括2小题,共19分)
25.(7分)
1.00 L该氨水中含氨的质量为12.0 mol×17.0 g/mol (1分)
其体积在标准状况下为 12.0 mol×22.4 L/mol (1分)
1.00 L该氨水中含水的质量为 1.00 L×915 g/L-12.0 mol×17.0 g/mol (1分)
其体积为![]() (2分)
(2分)
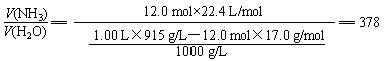
l体积水吸收378体积NH3气(标准状况)。 (2分)
若直接列出总式,同样给分:
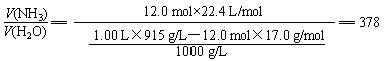
1体积水吸收378体积NH3气(标准状况)。
26.(12分)
(1)![]()
m(CO2+H2O)== 9.3 g
m(H2O)== 9.3 g-6.6 g == 2.7 g (2分)
(2)![]() (1分)
(1分)
![]() (1分)
(1分)
分子中C︰H == 1︰2
![]()
![]()
所以该气体的分子式是C2H4 (3分)
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等) (5分)
解题思路:因为单一气体为C2H4,现为等物质的量的两种气体之混合物,所以在2 mol混合气体中,应含有4 mol C原子,8 mol H原子,这两种气体可能是C4H6和H2。