高考理科综合能力测试(化学部分)
第I卷(选择题 共22题 每题6分 共132分)
(化学9题,共54分)
在下列各题的四个选项中,只有一个选项是最符合题目要求的。
以下数据可供答题时参考:
原子量:H 1 C 12 N 14 O 16
6.在食品加工或餐饮业中使用量特别要注意严加控制的物质是
A.氯化钠 B.谷氨酸钠(味精) C.碳酸氢钠 D.亚硝酸钠
7.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观象冰。1体积“可燃冰”可储藏100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是
A.“可燃冰”有可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”提供了水可能变成油的例证
D.“可燃冰”的主要可燃成分是甲烷
8.某元素的两种同位素,它们的原子具有不同的
A.质子数 B.质量数 C.原子序数 D.电子数
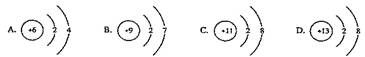
9.在下图所表示的微粒中,氧化性最强的是
10.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+ Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
A、Sn2+、Fe2+、Ce3+ B、Sn2+、Ce3+、Fe2+
C、Ce3+、Fe2+、Sn2+ D、Fe2+、Sn2+、Ce3+
11.有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A、V3>V2>V1 B、B3=V2=V1 C、V3>V2=V1 D、V1=V2>V3
12.下列离子方程式中,正确的是
A.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
B.小苏打溶液与稀硫酸混合:CO32-+2H+=CO2↑+H2O
C.大理石溶解于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.明矾溶液加热水解生成沉淀:Al3++3H2O![]() Al(OH)3↓+3H+
Al(OH)3↓+3H+
13.下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是
A.蔗糖 B.麦芽糖 C.丙酸丙酯 D.丙酸乙酯
14.在相同的温度和压强下,四个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a.CO2,100mL:b.O2,200mL:C.N2,400mL:d.CH4,600mL。则4个容器中气体的质量由大到小的顺序是
A、a>b>c>d B、b>a>d>c C、c>d>b>a D、d>c>a>b
第II卷(非选择题 共12题 共168分)
(化学5题,共66分)
29.(12分)
向纯碱溶液中滴入酚酞溶液,观察到的现象是 ,原因是 ;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是 ,原因是
.
30.(10分)
X、Y、Z三种元素位于周期表前20号元素之中。
已知:①XY2加水生成Y2Z2和化合物D;
②X的氧化物加水也生成D;
③ Y的氧化物有两种。
请填空:(1)X、Y、Z的元素符号为:X 、Y 、Z 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
31.(14分)
在抗击非典型肺炎期间,过乙酸(过氧乙酸)曾被广泛用作消毒剂。
已知硫酸和过硫酸的结构简式如下:
硫酸: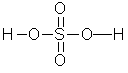 过硫酸:
过硫酸: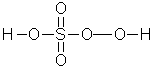
请从以下八个式子中选择答案回答以下问题(答案用编号表示,选错要倒扣分)。
(a)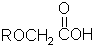 (b)
(b)![]() (c)H2O2
(c)H2O2
(d)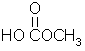 (e)
(e)![]() (f)
(f)![]()
(g)O3
(h)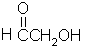
(1)过乙酸(过氧乙酸)的结构简式为 。
(2)过乙酸的同分异构体是 。
(3)过乙酸的同系物是 。
(4)氧的质量分数最小的物质是 。
32.(18分)
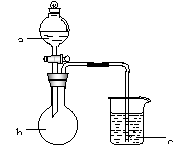 用示意图中的装置进行A、B、C、D四组实验,在A、b、c中加入的试剂如表中所示。填写表中空格。
用示意图中的装置进行A、B、C、D四组实验,在A、b、c中加入的试剂如表中所示。填写表中空格。
| a | b | c | 实验现象 | 对实验现象的解释 | ||
| A | 饱和 食盐水 | 碳化钙 | 酸性 KMnO4 溶液 | b中 |
| |
| c中 | ||||||
| B | 浓盐酸 | KMnO4 固体 |
N aB r 溶液 | b中 | ||
| c中 | ||||||
| C | 稀盐酸 | 大理石 | Na2SiO3 溶液 | b中 |
| |
| c中 | ||||||
| D | 浓硫酸 | 浓盐酸 | 紫色石蕊试液 | b中 | ||
| c中 |
| |||||
33.(12分)周期表前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族A与C、B与E原子的电子层数都相差2,A、B原子的最外层电子数之比为1:4。
(1)写出元素符号:B ,D ,E 。
(2)A和C能以原子数1:1形成一种化合物,写出该化合物的化学式 。
理科综合能力测试(化学部分)
参考答案及评分标准
I卷包括9个小题,每题6分,共54分。
| 题号 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | D | C | B | B | A | C | D | A | C |
II卷包括5个小题,共66分。
29.(12分)
溶液显红色
碳酸钠水解(或答CO32-+H2O![]() HCO3-+OH-),溶液呈碱性,使溶液显红色。产生白色沉淀,且溶液的红色褪去。
HCO3-+OH-),溶液呈碱性,使溶液显红色。产生白色沉淀,且溶液的红色褪去。
加入CaCl2后,Ca2++CO32-=CaCO3↓使水解平衡向左移动,OH-离子浓度减少,使溶液褪色。
30.(10分)(1)Ca C H
(2)CaC2+H2O![]() C2H2↑+Ca(OH)2
C2H2↑+Ca(OH)2
(3)CaO+H2O![]() Ca(OH) 2
Ca(OH) 2
31.(14分)(1)b (2)a d (3)f (4)f
32.(18分)
| 实验现象 | 对实验现象的解释 | ||
| A | b中 | 有气泡生成 |
|
| c中 | 溶液由紫色褪成无色 | 乙炔易被氧化剂氧化 | |
| B | b中 | 有黄绿色气体生成 | KMnO4氧化性比氯气强 |
| c中 | 溶液由无色变橙色 | Cl2的氧化性比Br2强 | |
| C | b中 | 有气泡生成 |
|
| c中 | 有白色胶状沉淀生成 | 碳酸的酸性比硅酸强 | |
| D | b中 | 有白雾生成,放大量热 | 浓硫酸稀释时放大量热;盐酸是挥发性酸,与水汽结合呈雾状 |
| c中 | 紫色试液变红色 |
|
33.(12分)(1)Si F H (2)K2O2