高考能力测试步步高化学基础训练29
基础训练29 酸碱中和滴定
(时间60分钟,赋分100分)
●训练指要
本训练点包括:有关仪器的使用;中和滴定的实验操作及计算原理;中和滴定的误差分析。
一、选择题(每小题5分,共45分)
1.(2003年春季高考理综题)以上是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
2.有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL B.为40.0 mL
C.小于40.0 mL D.为10.0 mL
3.下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是
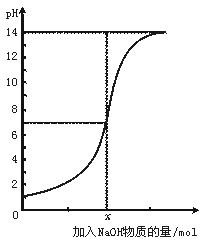
A.原来盐酸的物质的量浓度为0.1 mol·L-1
B.x处为0.1 mol的NaOH溶液
C.原来盐酸的物质的量浓度为1 mol·L-1
D.x处为0.01 mol的NaOH溶液
4.室温下用0.1 mol·L-1 NaOH溶液滴定a mL某浓度的HCl溶液,达到终点时消耗NaOH溶液b mL,此时溶液中氢离子的浓度c(H+)/mol·L-1是
A.![]() B.
B.![]()
C.1×107 D.1×10-7
5.用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
6.向某无色透明溶液中滴加甲基橙溶液后呈红色,在该溶液中能够大量共存的离子组是
A.K+、Na+、Fe3+、NO![]()
B.NH![]() 、Mg2+、K+、SO
、Mg2+、K+、SO![]()
C.Ca2+、Ba2+、NO![]() 、Cl-
、Cl-
D.Ba2+、Zn2+、CH3COO-、Cl-
7.下面是一段关于中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴石蕊试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。
文中所述操作有错误的序号为
A.④⑥⑦ B.①⑤⑥⑦
C.③⑤⑦ D.①③⑤⑦
8.相同体积的一元酸HA的溶液和一元碱BOH的溶液相混合后pH=7,下列叙述中正确的是
A.0.01 mol·L-1的BOH溶液的pH一定等于12
B.HA和BOH溶液物质的量浓度一定是前者小于后者
C.生成的盐BA一定不水解
D.一定有如下关系:c(A-)=c(B+)
9.有一溶液中含有的溶质是NaOH、NaHCO3、Na2CO3中的一种或两种,现取等体积的两份上述溶液分别以酚酞和甲基橙做指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1和V2,如果V1<V2<2V1,则上述溶液中的溶质是
A.NaHCO3 B.Na2CO3
C.NaHCO3和Na2CO3 D.Na2CO3和NaOH
二、非选择题(共55分)
10.(9分)取体积相同(0.025 L)的两份0.10 mol·L-1 NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH将 (填“增大”“减小”或“不变”),其原因是 。
用已知物质的量浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,中和另一份消耗硫酸溶液的体积为VB,则:
(1)以甲基橙为指示剂时,VA与VB的关系是: ;
(2)以酚酞为指示剂时,VA与VB的关系是: 。
11.(10分)用中和滴定的方法测定NaOH和Na2CO3混合溶液中的NaOH含量时,可先在混合溶液中加过量BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。
试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量?
(2)到滴定终点时溶液的颜色如何突变?
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到达滴定终点,能否由此得出准确的测定结果?
(4)能否改用甲基橙作指示剂?若使用甲基橙作指示剂,则测定结果如何(填“偏高”“偏低”或“正确”)?
12.(12分)草酸晶体的组成可表示为H2C2O4·xH2O,为测定x的值进行下述实验。
A.称取m g纯草酸晶体,将其配成100 mL溶液作为待测液
B.取25 mL待测液置于锥形瓶中,再加入适量的稀H2SO4,用浓度为a mol·L-1的KMnO4溶液滴定,滴定所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
试回答:(1)实验A欲配制准确浓度的草酸待测液,必须使用的仪器是 。
(2)用KMnO4进行滴定时,KMnO4溶液应装在 中,操作时用 手拿锥形瓶。
(3)若滴定时所用的KMnO4溶液因久置而浓度变小,则所测定的x值将 。
(4)假定滴定中共用去KMnO4溶液V mL,则待测草酸溶液的物质的量浓度为 ,由此计算出草酸晶体中结晶水x的值为 。
13.(12分)在滴定操作中,确定滴定管中的标准液起始和终了液面读数时,判断下列操作的影响:
(1)起始时液面已调至刻度0处,终了时确定液面读数时俯视液面 ( )
(2)起始时确定液面读数时俯视液面,而终了时仰视液面( )
(3)起始时确定液面读数时仰视液面,而终了时俯视液面( )
(4)起始时确定液面读数时仰视液面,而终了时平视液面( )
(5)起始和终了时确定液面读数,均仰视液面( )
A.测得待测液浓度偏高
B.测得待测液浓度偏低
C.测得待测液浓度正确
D.无法确定滴定结果是否正确
14.(12分)为检验工业废水中苯酚的含量,需进行下列实验:
①配制标准溴试剂并测定其浓度。将KBrO3与过量KBr混合溶于水配成标准溴试剂。取标准溴试剂25 mL,依次加入过量稀H2SO4和过量的KI溶液,然后用0.100
mol·L-1的Na2S2O3溶液滴定(I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() ),结果消耗18.7 mL的Na2S2O3。
),结果消耗18.7 mL的Na2S2O3。
②测定工业废水中苯酚的含量(mg·L-1)。取工业废水100 mL与25.0 mL上述标准溴试剂混合,再加入过量稀H2SO4,充分反应后,加入过量KI,用0.100 mol·L-1的Na2S2O3溶液滴定,结果消耗了Na2S2O3溶液14.2 mL。
根据上面的叙述回答下列问题:
(1)写出标准溴试剂加入H2SO4产生单质溴的化学方程式:
(2)计算标准溴试剂中KBrO3的物质的量浓度。
(3)求工业废水中苯酚的含量(用mg·L-1表示)。
高考能力测试步步高化学基础训练29答案
一、1.B 2.A 3.AD 4.D 5.C 6.BC 7.D 8.D 9.D
二、10.减小 NaOH与空气中的CO2反应,使NaOH减少,故溶液的pH减小
(1)VA=VB (2)VA<VB
11.(1)因为酚酞的变色点是pH为8,此时呈弱碱性,只有NaOH与HCl反应,BaCO3不与HCl反应。(2)浅红色变为无色 (3)不能。 (4)不能;因甲基橙的变色点是pH=4.4,此时溶液呈弱酸性,已有部分BaCO3与HCl反应而导致测定结果偏高。
12.(1)100 mL容量瓶、天平、烧杯、胶头滴管、玻璃棒
(2)酸式滴定管 右
(3)偏小
(4)0.1aV mol·L-1 ![]() -5
-5
13.(1)B (2)A (3)B (4)B (5)D
14.(1)KBrO3+5KBr+3H2SO4===3K2SO4+3Br2+3H2O
(2)1.25×10-2 mol·L-1
(3)70.5 mg·L-1