高考统一标准测试化学试验(二)
(试验修订教材版)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1至4页,第Ⅱ卷5至8页。共150分。考试时间120分钟。
第Ⅰ卷(选择题共72分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束,将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.K35ClO3与K37Cl在酸性溶液中反应生成氯气,则该氯气的相对分子质量为
A. 70.7 B. 70.2 C. 72 D. 73.3
2.科学工作者对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质,将它命名为“类铅”,以下对“类铅”叙述正确的是
A.最外层有6个电子
B.最高价氧化物有较强的氧化性
C.主要化合价有+3、+4价
D.电解硝酸铜与硝酸“类铅”的混合溶液,首先析出“类铅”
3.吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内活性氧,则Na2SeO3的作用是
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.以上均不是
4.含C为a mol的金刚石中含C—C键数为
A.4 a×6.02×1023 B.a×6.02×1023
C.2 a×6.02×1023 D.8 a×6.02×1023
5.通常情况下,配制一定物质的量浓度的NaCl溶液和H2SO4溶液所用仪器不同的是
A.烧杯 B.玻璃棒 C.容量瓶 D.托盘天平
6.美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。以下表示反物质酸碱中和反应的通式是
A.H-+OH+==== H2O B. H++OH+====H2O
C.H-+OH―====H2O D. H++OH―====H2O
7.验钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上6 mol·L-1的盐酸,过一段时间若观察到有粗线裂纹,表明该处原先确有看不见的细裂纹,产生粗裂纹的主要原因是
A.原纹处有碳积存
B.裂纹处表面积很大,反应快
C.裂纹处的尘埃起催化作用
D.裂纹处有氧化铁积存,并与盐酸作用生成可溶性氧化物
8.4 g某种铁的氧化物,用足量的一氧化碳在高温下将其还原,再把生成的二氧化碳全部通入足量澄清的石灰水,得到7.5g沉淀物,该铁的氧化物是
A.Fe3O4 B.FeO C.Fe2O3 D.FeO和Fe3O4
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就得0分)
9.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用,下列化学反应,不符合绿色化学概念的是
A.消除硫酸厂尾气中的SO2:SO2+2NH3+H2O====(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH====2NaNO2+H2O
C.制CuSO4:Cu+2H2SO4 (浓)====CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2====2CuO,CuO+H2SO4 (稀)====CuSO4+H2O
10.某共价化合物含C、H、N 3种元素,已知其分子内的4个氮原子排列成内空的四面体结构,且每2个氮原子间都有1个碳原子,分子中无C—C、C==C、C≡C键,则此化合物的化学式是
A.C6H12N4 B.C4H8N4 C.C6H10N4 D.C6H8N4
11.在“神舟”号飞船中,可作为宇航员供氧剂的物质是
A.Na2O B.Na2O2 C.KClO3 D.H2O2
12.设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.在标准状况下,11.2 L Ne中含有NA个原子
B.在标准状况下,0.5 mol辛烷所占的体积约为11.2 L
C.由D与18O组成的水10 g所含的中子数为6 NA
D.2 L 0.1 mol·L-1的硫酸铵溶液中,所含有的SO![]() 为0.2 NA
为0.2 NA
13.航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2H2+O2====2H2O,该电池的正极反应可表示为
A.4H++4e-====2H2↑ B.O2+2H2O+4e-====4OH―
C.4OH―-4e-====O2↑+2H2O D.2H2-4e-====4H+
14.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++CO![]() +H2O====Cu(OH)2↓+CO2↑
+H2O====Cu(OH)2↓+CO2↑
次要:Cu2++CO![]() ====CuCO3↓
====CuCO3↓
CuSO4+Na2S 主要:Cu2++S2―====CuS↓
次要:Cu2++S2―+2H2O====Cu(OH)2↓+H2S↑
下列几种物质溶解度大小的比较中,正确的是
A.Cu(OH)2>CuCO3>CuS B.Cu(OH)2<CuCO3<CuS
C.CuS>Cu(OH)2>CuCO3 D.CuS<Cu(OH)2<CuCO3
15. 下列各组离子在溶液中可以大量共存,且加入足量氨水后也不产生沉淀的是
A.Na+、Ba2+、Cl―、SO![]() B.H+、NH
B.H+、NH![]() 、Al3+、SO
、Al3+、SO![]()
C.H+、Cl―、CH3COO―、NO![]() D. K+、AlO
D. K+、AlO![]() 、NO
、NO![]() 、OH―
、OH―
16.医学家最近合成了一种具有抗癌活性的化合物Depudecin,该物质也曾从真菌里分离出来,其结构简式如下:
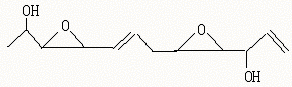
下列关于该化合物的说法正确的是
A.该化合物的分子式为C12H16O4
B.该化合物属于有机酯类
C.该化合物既可发生消去反应,也可被催化氧化生成醛
D.该化合物的分子中处于同一平面的原子可能有6个
17.在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态时的1.8倍。下列叙述正确的是
cZ(g)+dW(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态时的1.8倍。下列叙述正确的是
A.平衡向正反应方向移动 B.(a+b) >(c+d)
C.Z的体积分数变大 D.X的转化率变小
18.摄影胶卷上涂布的感光物质主要是AgBr。照相时,在快门按动的一瞬间,进入相机的光使AgBr发生了分解反应:2AgBr![]() 2Ag+Br2。由于进光量极少,分解出的Ag极少,所以必须通过化学反应进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
2Ag+Br2。由于进光量极少,分解出的Ag极少,所以必须通过化学反应进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
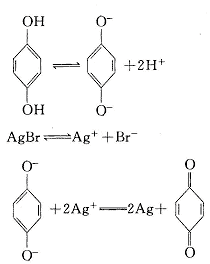
下列关于显影过程的叙述错误的是
A.在显影过程中 是还原剂
B.在显影液中加入一定量Na2CO3,可加快显影速度
C.溶于显影液的O2能加快显影速度
D.曝光时产生的微量Ag在显影时起了催化作用
第Ⅱ卷(非选择题共78分)
注意事项:1.第Ⅱ卷共4页,用钢笔或圆珠笔将答案直接写在试题卷上。
2.答卷前将密封线内的项目填写清楚。
题号526Ⅱ卷总分得分三、(本题包括2小题,共20分)
19.(8分)设计实验,鉴定明矾\[KAl(SO4)2·12H2O\]的成分。
20.(12分)“套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其
具有许多优点,近年被广泛开发并应用于化学实验中,下述两个实验均为“套管实验”,请观察实验装置,分析实验原理,回答下列问题:
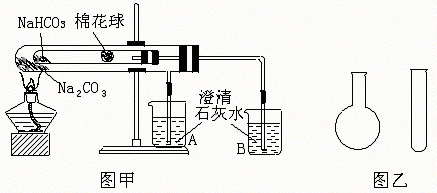
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球。
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有 。
(2)整个实验结束时,在操作上需要特别注意的问题是 。
(3)通过该实验可以得出的结论是 。
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦。请设计一个简单的操作方法,只用一支试管(如图乙),选用下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验的氨气。
(4)所用的试剂为 。
(5)请简述所设计的操作及判定集满氨气的现象: 。
(6)产生氨气的化学反应方程式为 。
(7)将上述两个实验与普通实验相比较,“套管实验”明显具备的优点是 。
四、(本题包括2小题,共20分)
21.(8分)在10 ℃和2×105
Pa条件下,反应aA(g)![]() dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强 下反应建立平衡时物质D的浓度:
dD(g)+eE(g)建立平衡后,再逐步增加体系的压强(保持温度不变)。下表列出不同压强 下反应建立平衡时物质D的浓度:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据回答下列问题:
(1)压强2×105 Pa增加到5×105 Pa时,平衡向反应方向 移动(填“正”或“逆”),其理由是 。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向 反应方向移动(填“正”或“逆”),其理由是 。
22.(12分)在一定条件下(不需要添加别的反应物),经不同的化学反应,可实现如下图的各种反应。其中,反应③、④、⑤属氧化还原反应,而反应
①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要组成成分之一,其余为化合物,据此请填空:
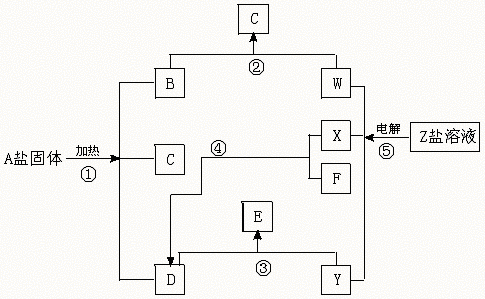
(1)物质A是 ,F是 ,X是 ,Y是 。
(2)写出反应②的化学方程式 。
(3)写出反应④的化学方程式,并注明反应条件 。
五、(本题包括2小题,共20分)
23.(12分)在国际环境问题中,一次性使用的聚苯乙烯材料所带来的“白色污染”问题甚为突出。中国杨凌农业科技开发区某公司已开发出60天自行降解功能的绿色包装材料聚乳酸(分子组成可表示为C3nH4n+2O2n+1)
(1)聚苯乙烯材料会造成“白色污染”,是因为 。
(2)乳酸是以淀粉为原料水解成葡萄糖,再经乳酸菌发酵制得:
|
①跟NaOH反应,消耗了1.0 mol·L-1的NaOH溶液100 mL。由此说明 。
②跟足量的金属钠反应,放出气体240 mL(标准状况下)。由此说明 。
③以银为催化剂跟O2反应,生成物为CH3COCOOH。由此说明 。
因此,乳酸分子的结构简式为 。
(3)试写出两个乳酸分子间反应生成C6H8O4的化学方程式(有机物用结构简式表示,以下同) 。
(4)试写出乳酸分子间通过 反应,生成聚乳酸的化学方程式 。
(5)聚乳酸材料废弃后,首先水解成单体,然后在微菌作用下分解成二氧化碳和水。试写出这两步反应的化学方程式 。
得分评卷人
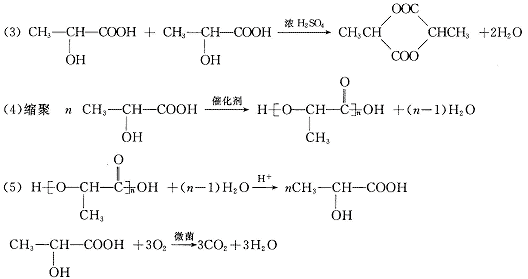
24.(8分)“柯达尔”是一种高聚物,其结构式为
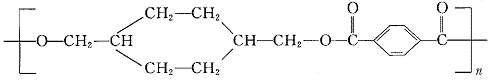
已知在一定条件下可以发生如下反应:
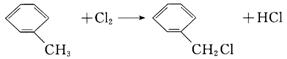
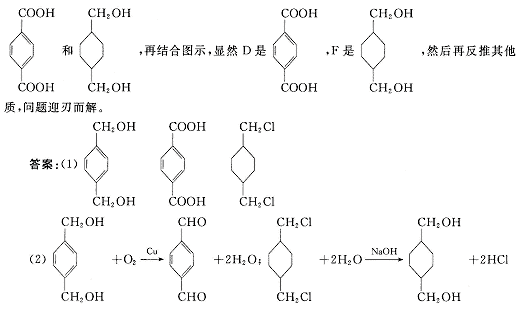
工业上以石油产品对二甲苯为原料合成“柯达尔”的方案如下
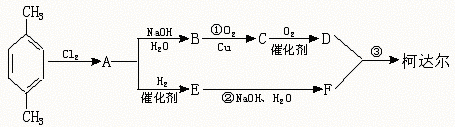
回答以下问题:
(1)写出结构简式:B D E ;
(2)写出化学方程式:B![]() C
C
E![]() F
F
(3)D+F![]() 柯达尔(反应类型
)
柯达尔(反应类型
)
六、(本题包括2小题,共18分)
25.(8分)用质量分数为98%浓H2SO4(密度为1.8 g· cm-3)配制1∶5 H2SO4 500 mL(密度为1.2 g·cm-3),应取质量分数为98%的浓H2SO4多少mL? 配制的1∶5 H2SO4溶液的质量分数和物质的量的浓度各是多少?
26.(10分)有碳原子数均不大于4的两种链状饱和一元醇0.3 mol,其质量为13.8 g。完全燃烧0.4 mol此混合物所生成的二氧化碳和水的物质
的量比反应前混合醇与氧气物质的量之和增加0.4 mol。求这两种醇的分子式、结构简式和物质的量之比。
高考统一标准测试化学试验(二)答案
一、1.D K35ClO3与K37Cl在酸性溶液中发生氧化还原反应生成氯气(35Cl—37Cl):35ClO![]() +37Cl―+H+
+37Cl―+H+![]() 35Cl35Cl + H2O
35Cl35Cl + H2O
根据电子转移守恒有:
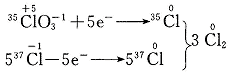
取生成的Cl23 mol,其中必含1 mol 35Cl和5 mol 37Cl,则氯气的相对分子摩尔质量为:![]() =73.3 g/mol,氯气的相对分子质量为73.3,故选D。
=73.3 g/mol,氯气的相对分子质量为73.3,故选D。
2.B
3.B Na2SeO3类比于Na2SO3,Na2SO3易被氧氧化成Na2SO4,同理Na2SeO3可清除体内活性氧充当还原剂。
4.C 金刚石为空间正四面体形网状结构,每个碳原子的4个价电子都用以其他碳原子形成共价单键4个。1 mol金刚石共含4 mol价电子,因2 mol价电子形成1 mol C—C键,所以4 mol价电子共可形成2 mol C—C键,故选C。
5.D 配制NaCl溶液用固体氯化钠,需要用托盘天平称取一定量的溶质,而配制H2SO4溶液用浓硫酸,需要用量筒量取而不是使用天平。
6.A 注意对“反物质”特征的理解,显然A正确。
7.D 钢板裂纹处的铁易被氧化,故选D。
8.C
二、9.C 由于C选项在制备CuSO4产物的同时,生成了大气污染物SO2,故本题答案选C。
10.A
11.B 因为2CO2+2Na2O2====2Na2CO3+O2,故本题答案选B。
12.D
11.2 L Ne在标准状况下的物质的量为0.5 mol,且它为单原子分子,应有0.5 NA原子,故A不正确。在标准状况下,辛烷为液态,故B不正确。10 g D218O所含中子的物质的量为10 g22 g·mol-1×12≠6 mol,故C不正确。(NH4)2SO4的物质的量为0.2 mol,显然SO![]() 为0.2 NA,故选D。
为0.2 NA,故选D。
13.B 要求写电池的正极反应,正极反应过程中是得到电子被还原,发生还原反应,再结合电池的总反应方程式,可知选B。
14.D 本题的关键是对溶液中的离子反应实质的理解。离子反应使越易向离子浓度减小的方向进行。
由此,可知溶解度的大小比较:CuS< Cu(OH)2< CuCO3,应选D。
15.D A项BaSO4不溶于水,SO![]() 与Ba2+不能共存。B项H+、NH
与Ba2+不能共存。B项H+、NH![]() 、Al3+、SO
、Al3+、SO![]() 可共存,加入大量氨水,则生成沉淀,Al3++3NH3·H2O====Al(OH)3↓+3NH
可共存,加入大量氨水,则生成沉淀,Al3++3NH3·H2O====Al(OH)3↓+3NH![]() 。C项,H+与CH3COO―不能大量共存。D项,可以共存,加氨水后也不变化。
。C项,H+与CH3COO―不能大量共存。D项,可以共存,加氨水后也不变化。
16.D A.从结构可看出C原子为12,O原子为4,其中结构中有二个双键,二个环,所以H原子数为:12×2+2-4×2=18,分子式为C12H18O4;B.该化合物结构中不含有官能团![]() 所以不属于有机酯;C.该化合物结构中在仲碳原子上连有羟基,所以能发生消去反应,但催化氧化时应生成酮;D显然正确。
所以不属于有机酯;C.该化合物结构中在仲碳原子上连有羟基,所以能发生消去反应,但催化氧化时应生成酮;D显然正确。
17.D aX(g)+bY(g)
![]() cZ(g)+dW(g),达到平衡后加压,容器容积缩小一半,W的浓度应增大2倍,而实际只增大1.8倍,说明平衡向逆反应方向移动:(a+b)<(c+d);Z的体积分数降低,X的转化率变小,所以D选项正确。
cZ(g)+dW(g),达到平衡后加压,容器容积缩小一半,W的浓度应增大2倍,而实际只增大1.8倍,说明平衡向逆反应方向移动:(a+b)<(c+d);Z的体积分数降低,X的转化率变小,所以D选项正确。
18.C根据题意可知对苯二酚具有还原性,能被Ag+氧化,则应能被O2氧化,故C项不正确,应选C。
三、19.解析:明矾的成分是KAl(SO4)2·12H2O,要鉴定其成分,就要证明其含有K+、Al3+、SO![]() 和结晶水。
和结晶水。
答案:实验步骤如下:
(1)取少量明矾固体,放入一支干燥的试管中,用酒精灯给试管中的固体加热,观察试管内壁上的现象。(应有水珠出现)
(2)取少量明矾放入烧杯中,加蒸馏水搅拌配成稀溶液。向三支试管中分别加入明矾溶液。
(3)向第一支试管中滴入NaOH,观察沉淀的生成量与NaOH的量的关系。(证明有Al3+)
(4)向第二支试管中滴加BaCl2溶液和稀盐酸,观察产生的现象(证明有SO![]() )。
)。
(5)用一根洁净的铂丝蘸取第三支试管中的溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察火焰的颜色(证明含有K+)。
20.(1)棉花球变蓝;B中石灰水变浑浊;开始时A中有气泡产生;小试管内有液滴出现
(2)防止倒吸
(3)NaHCO3的热稳定性比Na2CO3的差,NaHCO3分解有CO2和H2O生成
(4)B C(E)或ABC(E)
(5)将圆底烧瓶倒置,向试管中分别加入所选试剂,迅速将试管的上口伸至烧瓶的底部,过一会将湿润的红色石蕊试纸置于烧瓶口处,若试纸变蓝,则说明NH3已集满
(6)NH3·H2O====NH3+H2O(或同时有:NH4Cl+NaOH====NH3↑+NaCl+H2O)
(7)简化实验操作,提高实验效果,节约药品
四、21.解析:本题给出了不同压强下D的浓度数据,需要通过比较压强的增大倍数与D浓度的增大倍数,从而判断平衡的移动方向。但这里出现的问题是:同样加压,平衡移动方向却相反,这就需要联想加压会引起物质状态的改变,使E物质液化,从而改变平衡移动方向。
答案:(1)逆压强增大2.5倍,而D浓度增大2.3倍,压强增大倍数大于D浓度增大倍数
(2)正压强增大2倍,而D浓度增大2.2倍,压强增大倍数小于D浓度增大倍数,故平衡向正反应方向移动。这是由于加压后E被液化使平衡正移
22.解析:A盐固体受热分解为三种物质,且为非氧化还原反应。由此很容易想到可能是(NH4)2CO3或NH4HCO3。又因为电解Z盐溶液生成三种物质,其中两种物质(X和Y)为单质,且X与F化合生成D,结合这两点,X应为H2,F为N2,D为NH3。这样Z盐应似NaCl或KCl,则Y为Cl2,W为NaOH或KOH,A盐确实为(NH4)2CO3或NH4HCO3,B为CO2,G为Na2CO3或NaHCO3,C为水,E为HCl或NH4Cl(NH3过量时)。
答案:(1)(NH4)2CO3或NH4HCO3 N2 H2 Cl2
(2)CO2+2NaOH====Na2CO3+H2O或CO2+NaOH====NaHCO3
|
(3)N2+3H2![]() 2NH3
2NH3
五、23.(1)其废物在自然界中难于被生物降解,也不能焚烧(会产生大量有毒物质),不能掩埋(会影响土壤中的水分和空气流动)
(2)①乳酸为一元酸②乳酸分子中除含一个羧基外,还含一个羟基③乳酸分子中的羟基在羧基相邻的碳原子上![]()
24.解析:本题关键从题意中提供“柯达尔”高聚物的有机结构信息不难推出它的两种单体是
六、25.解析:设应取质量分数为98%的浓H2SO4 x mL
根据溶液质量守恒可得
1.8x+5x×1=500×1.2 x=88.2 mL
1∶5
H2SO4溶液的质量分数为![]() ×100%=25.9%
×100%=25.9%
1∶5
H2SO4溶液的物质的量的浓度为![]() =3.18 mol·L-1
=3.18 mol·L-1
答案:应取质量分数为98%的浓H2SO4 88.2 mL;1∶5 H2SO4溶液的质量分数为25.9%,物质的量的浓度为3.18 mol·L-1。
26.解析:先求平均相对分子质量M:M=![]() =46
=46
设式量较小的一种醇为CnH2n+2O,式量为14n+18,14n+18<46,14n<28,n<2。所以必有一种是甲醇,另一种碳原子大于2而小于5的可能是丙醇,也可能是丁醇。
设平均“化学式”为CmH2m+2O,有
CmH2m+2O+3m/2O2![]() mCO2+ (m+1)H2O
mCO2+ (m+1)H2O
1 3m/2 m m+1
前后物质的量之差为m/2,由已知条件得1∶m/2= 0.4∶0.4,m=2。
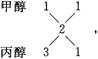 |
当混合物为甲醇与丙醇时,计算平均碳: n(甲醇)∶n(丙醇)=1∶1。
当混合物为甲醇与丁醇时,有 ,n(甲醇)∶n(丁醇)=2∶1。
