高 三 化 学
(第二学期第5周)
【氮族元素综合练习】
一、选择题(每小题有1~2个正确答案)
1、标况下nLNH3溶于水中得到密度为![]() 的氨水AL,则此氨水的质量分数为
的氨水AL,则此氨水的质量分数为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
2、室温,将NO和O2以体积比3:1混合,则混合气体平均式量最接近
A. 40.7 B. 46 C. 30.5 D. 61
3、下列叙述正确的是
A. 检验某稀溶液中是否含有NO3-,可加入浓H2SO4和铜片,观察有无红棕色气体产生
B. 鉴别NO2和溴蒸气可用AgNO3溶液,而不能用淀粉KI溶液
C. 向H3PO4溶液中加入AgNO3溶液,观察有黄色沉淀生成,证明有PO43-存在
D. 检验溶液中是否含NH4+,可加入足量NaOH溶液,加热,再用红色湿润的石蕊试纸伸入试管内检验是否变蓝。
![]() 4、已知N N键能为
4、已知N N键能为![]() ,下列对三氯化氮(NCl3)叙述正确的是
,下列对三氯化氮(NCl3)叙述正确的是
A. 具有较高的熔沸点
B. NCl3的分解反应是放热反应
C. 它还可以通过氮原子间的配位键跟氯原子逐步结合
D. NCl3分子为三角锥形,可知它一定是极性分子
5、化合物M溶于水加少量AgNO3溶液有白色沉淀,如果先在M的水溶液中加入一定量的NaOH溶液,再加少量AgNO3溶液,则无沉淀生成,M可能是
A. NaCl B. CaCl2 C. MgCl2 D. NH4Cl
6、将0.1mol·L-11mL H3PO4溶液与13mL 0.02mol·L-1 KOH溶液混合后,能表示此反应的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
7、向三份V体积![]() 溶液中分别加入
溶液中分别加入![]() 的H3PO4溶液,反应后分别生成
的H3PO4溶液,反应后分别生成![]() 、
、![]() 、
、![]() 所需H3PO4溶液的体积比为
所需H3PO4溶液的体积比为
A. 1:2:3 B. 3:2:1 C. 2:3:6 D. 6:3:2
8、384mg铜跟适量的浓HNO3反应,铜全部作用后,共收集到气体224mL(标况),反应消耗的HNO3的物质的量可能是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
9、可在实验室制取氨气的方法是
A. 在浓氨水中加固体NaOH并加热 B. NH4Cl溶液和NaOH溶液混合
C. 加热分解NH4Cl晶体 D. 加热消石灰和NH4Cl固体混合物
10、把aL含(NH4)2SO4和NH4NO3的混合液分成2等份,一份用bmolNaOH刚好把NH3全部赶出,加一份与BaCl2溶液完全反应,消耗c mol BaCl2则原溶液中[NO3-]为(mol·L-1)
A. ![]() B.
B. ![]() C.
C.
![]() D.
D. ![]()
11、向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是
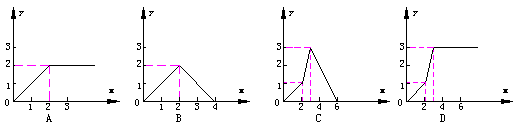 |
12、将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒体积的一半处停止了,则剩余气体的成份是
A. NO2 B. NO C. O2 D. NO或O2
13、Na3N是离子化合物,它与水作用产生NH3,下列叙述正确的是
A. Na3N与盐酸反应可产生两种盐
B. 在Na3N与水反应中,Na3N作还原剂
C. Na+与N3-电子层结构与氩原子结构相同
D. Na+半径比N3-半径大
根据下列叙述,回答第14~16题
1862年比利时索尔维以NaCl、CO2、NH3和H2O为原料制得纯净的Na2CO3,这个方法叫索尔维法,其简要过程如下:
(1)制小苏打![]()
(2)焙烧小苏打制得纯碱,CO2循环利用
(3)在析出的小苏打母液中加入生石灰,NH3循环利用。
1940年,我国著名化工专家侯德榜用NaCl固体代替生石灰,加入母液使NH4Cl晶体析出,生产纯碱和NH4Cl,这就是著名的“侯氏制碱法”。
14、在制小苏打的第一步中,应在饱和食盐水中
A. 先通入CO2达到饱和后再通NH3 B. 先通NH3饱和后再通入CO2
C. CO2和NH3同时通入 D. 以上三种方法都可以
15、NaCl固体使NH4Cl从母液中析出,主要破坏了NH4Cl在母液中的
A. 水解平衡 B. 电离平衡 C. 结晶溶解平衡 D. 沉淀溶解平衡
16、“侯氏制碱法”较之“索尔维法”优点是①得到了Na2CO3、NH4Cl两种有用产品②消除了无用的产物CaCl2③减少了CaO原料④原料得到充分利用⑤提高了纯碱的质量
A.①②③ B.①②③⑤ C.②③⑤ D.①②③④
17、将充有m mol NO和n mol NO2气体的试管倒立于水槽中,然后通入m mol O2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为
A. (4n-1)/2 B. (n-m)/3 C. (3m+n)/3 D. 3(n-m)
18、某硝酸盐R(NO3)2受热分解为RO、NO2、O2,在标准状况下,将生成的气体充满一烧瓶,并将烧瓶倒置于水中,当烧瓶中液面不再上升时烧瓶内溶液浓度是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
19、常温下,A、B两种气体组成的混合气体(MA>MB),经分析混合气体中只含氮氢两种元素,而且不论A和B以何种比例混合,N和H质量比总大于14/3,下列组合中符合这种条件的是
A. ![]() 、
、![]() B.
B. ![]() 、
、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
20、某一无色晶体要鉴定它是否为硫酸铵,下列操作必要的是
A. 加入NaOH溶液并加热,检验产生气体的性质
B. 加热有无气体放出
C. 晶体用蒸馏水溶解,用盐酸酸化,再加入BaCl2观察有无沉淀生成
D. 晶体溶解,加入Ba(NO3)2溶液,再加入HNO3看有无沉淀生成
21、在![]() 的反应中,每1mol CuSO4可氧化磷的物质的量是
的反应中,每1mol CuSO4可氧化磷的物质的量是
A. 0.73mol B. 0.6mol C. 0.4mol D. 0.2mol
22、a mol金属单质M和含2.5a mol HNO3的稀溶液恰好完全反应,氧化产物是M(NO3)2,则还原产物可能是
A. NO2 B. NO C. N2O D. NH4NO3
23、铜与![]() 溶液反应,如果[NO3-]下降了
溶液反应,如果[NO3-]下降了![]() ,则[H+]同时下降了
,则[H+]同时下降了![]()
A. 0.2 B. 0.4 C. 0.3 D. 0.8
24、下列分子的结构中原子的最外层电子不能都满足8电子稳定结构的是
A. CO2 B. PCl3 C. NO2 D. CCl4
25、等量的盐酸分别用PH=11和PH=10的氨水中和,设消耗氨水的体积前者为Va,后者为Vb,则Va、Vb关系正确的是
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
二、填空
1、雷雨中含微量的HNO3,用化学方程式解释HNO3的形成过程
_______________、 ________________、 _______________
2、K2O%为23.5%的KH2PO4复合肥中,P2O5%含量为 _____,肥料纯度为 _____。
3、把3体积的NO2气体依次通过下列三个分别盛有①NaHCO3饱和溶液。②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,集气瓶中气体应是 _____,体积为 _____(同温同压测定)
4、有A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,B不溶于水它也能与氧气反应生成C,A、C气体皆易溶于水,它们的水溶液酸碱性正好相反,则A、B、C分别为 _____、 _____、 _____。
![]() 5、在80℃和
5、在80℃和![]() 下,用图示装置进行如下实验,A、C两筒分别装有无色气体,它们可能含有NH3、O2、N2、H2S、NO、CO2等气体,B管内装有固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压时并未变化(1)C中发生的反应为 ______________。已知C中是单一气体,它是 ____(若有多种可能的答案,需一一列出),将反应后C中的气体用水充分吸收,在同温同压下气体体积减少一半,则与水反应前C中的气体是 ______(有多种可能答案需一一列出)(2)若实验前A、C中的气体体积(换算成标况)分别为1.40L和2.24L,且A中的气体经过B管后,B管质量增加1.40g,通过计算机推理可判断A中含气体是 ______,其质量为 _______g。
下,用图示装置进行如下实验,A、C两筒分别装有无色气体,它们可能含有NH3、O2、N2、H2S、NO、CO2等气体,B管内装有固体,推动A的活塞使A筒内气体缓缓地全部通过B后进入C筒,C中的气体由无色变成红棕色,但其体积换算成同温同压时并未变化(1)C中发生的反应为 ______________。已知C中是单一气体,它是 ____(若有多种可能的答案,需一一列出),将反应后C中的气体用水充分吸收,在同温同压下气体体积减少一半,则与水反应前C中的气体是 ______(有多种可能答案需一一列出)(2)若实验前A、C中的气体体积(换算成标况)分别为1.40L和2.24L,且A中的气体经过B管后,B管质量增加1.40g,通过计算机推理可判断A中含气体是 ______,其质量为 _______g。
6、某温度下,将一定量密度为1.15g/cm3的NaCl溶液通电,当NaCl恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量百分含量为80%,则电解后溶液中溶液质与溶剂的物质的量之比为 ______,原NaCl溶液的物质的量浓度为 _______。
7、在使10mL试管充满NO2和O2将其倒立于盛有足量水的水槽中,若完全反应后,试管内剩余气体的体积为y mL,原混合气体中NO2的体积为x mL,试写出x的取值范围不同时,y与x的关系式(1) _____________________ (2) ______________________。
8、常温下有一种混合气体,可能由He、H2、O2、N2、NH3、NO、HCl、CO2等气体中的几种所组成,取200mL混合气体进行如下实验:①将混合气体通过浓H2SO4体积减少40mL②余下气体通过Na2O2固体容器中充分反应后,体积又减少40mL③将②剩余气体引燃后,再冷却到室温,气体体积减少105mL④最后的剩余气体中有5mL是O2⑤整个反应过程中气体颜色无变化。试回答(1)混合气体一定有哪些气体?各占多少mL? _______________________
(2)混合气体中一定没有哪些气体 _______________(3)混合气体中可能有哪些气体 _______________。
9、氮有多种氧化物,其中之一的N2O3极不稳定,在液体或蒸气中大部分分离成NO和NO2,因而在NO氧化为NO2的过程中几乎没有N2O3生成,同样亚硝酸也不稳定,在微热甚至冷的条件下即分解。亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2和NO气体。(1)亚硝酸分解的化学方程式是 _____________________(2)酸性溶液中亚硝酸钠和碘化钾反应制取NO的离子方程式是 __________________。(3)在隔绝空气条件下,按下列操作制取NO:先取亚硝酸钠溶液适量加入稀盐酸片刻后,再加入KI溶液,试问这样的气体是否纯净?为什么? ____________________________________________________________。
![]() 10、红磷虽较稳定,但在未密闭情况下久置往往表面发粘发潮。磷在空气中与O2作用有P2O3生成,它是白色固体,熔点23.8℃,经实验证明它的化学式应为P4O6(1)同一条短线代表共价键,把右图中
10、红磷虽较稳定,但在未密闭情况下久置往往表面发粘发潮。磷在空气中与O2作用有P2O3生成,它是白色固体,熔点23.8℃,经实验证明它的化学式应为P4O6(1)同一条短线代表共价键,把右图中
磷原子与氧原子连接起来,成为表示P4O6立体结构图。
(2)P4O6在空气中受热可能转化为P4O10,它的结构与P4O6相似,P4010的立体结构图是 _____________。
(3)写出P4O6与HCl气体反应生成能在空气中形成白雾的氯化磷化学方程式 _____________。
11、NO2与NH3在一定条件下充分反应得到非常稳定的产物,其化学方程式为_____________。若20mL混合气体在一定条件下反应,(按上述反应进行),已知实际参加反应的NO2比NH3少2mL,则原混合气体中NO2和NH3的物质的量之比为 ______或 _______。
三、计算
1、一块铜片投入一浓HNO3的试管中,充分反应后铜片有剩余,若将反应产生的气体用隔绝空气的方法收集,可得67.2mL(不计水蒸气)测得此气体对H2的相对密度为28,若将此气体与33.6mLO2混合后通入水中,经过足够长的时间后,水刚好充满整个容器,求此实验中铜片减轻了多少克?有多少克HNO3被还原?(气体体积均在标况下测得)
2、![]() 的磷酸溶液中加入一定质量的NaOH固体,充分反应后,溶液中再加入过量CaCl2溶液,完全反应后得到2.91g沉淀。试求所加入的NaOH质量。
的磷酸溶液中加入一定质量的NaOH固体,充分反应后,溶液中再加入过量CaCl2溶液,完全反应后得到2.91g沉淀。试求所加入的NaOH质量。
3、取可能由CuCl2、FeSO4、KOH、Fe2(SO4)3、中几种组成的混合物,质量不足100g,做如下实验(1)把混合物溶于水,得澄清溶液A(2)用酸化后的A溶液中通足量H2S得沉淀11.2g(3)把100g铁棒浸入A溶液,待反应完全后取出铁棒经洗涤烘干称得质量是98g,并得到溶液B 500mL(4)测得B溶液中[Fe2+]=0.9mol·L-1,经计算推断混合物A的组成。
【综合练习答案】
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| B | A | B | BD | D | D | C | C | AD | B | D | C | A |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| B | C | D | B | D | D | AC | D | CD | D | C | D |
二、1、![]()
![]()
![]()
2、35.5% 68%
3、O2,0.25体积
4、NH3、NO、NO2
5、![]() ,NO,NO2和NO,O2和CO2,2.6g
,NO,NO2和NO,O2和CO2,2.6g
6、![]() ,
,![]()
7、(1)![]()
![]() (2)
(2)![]()
![]()
8、40mL NH3、80mL CO2、70mL H2,HCl、NO、O2,He或N2或He和N2
9、![]() ,
,![]()
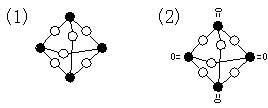 不能,因为
不能,因为![]() ,亚硝酸分解生成NO2。
,亚硝酸分解生成NO2。
10、
(3)![]()
(4)磷氧化成P2O5,P2O5极易吸水形成H3PO4,水洗烘干。
11、![]() 3:2或3:7
3:2或3:7
三、1、0.192g和0.252g
2、2g
3、0.1mol CuCl2,0.05mol Fe2(SO4)3,0.2mol FeSO4