电解质溶液
一.选择题(下列各小题有1个或两个答案符合题意)
1.下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D中选择:
A.M>N ` B.M<N C.M=N D.无法比较
(1)相同温度下,1L1mol·L—1 的NH4Cl溶液中的NH4+个数和2升0.5mol/LNH4Cl溶液中NH4+的个数 ( A )
(2)相同温度下,PH值为12的烧碱溶液中水的电离度和PH值为12的NaCN溶液中水的电离度( B )
(3)两份室温时的饱和石灰水,一份升温到50℃;另一份加入少量的生石灰,恢复至室温,两溶液中的[Ca2+] ( B )
(4)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中[HCO3—]....... ( B )
(5)将PH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的PH值................... ( B )
(6)向苯酚钠溶液中通入少量CO2,只生成碳酸氢钠,则同温度同浓度的苯酚钠溶液和碳酸钠溶液的PH值 ( B )
(7)常温下0.1mol/LCH3COOH溶液与0.1mol/LCH3COONa溶液等体积混合后溶液中的[Na+]和[CH3COO—] ( B )
(8)同温度下,0.1mol/LFeCl3溶液中Fe3+水解百分率与0.01摩/升FeCl3溶液中Fe3+ 的水解百分率.( B )
(9)室温下某强酸和某强碱溶液等体积混合,所得溶液的PH值为7,原酸溶液和原碱溶液的物质的量浓度 ( D )
(10)PH值相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原来的M倍和N倍,稀释后两溶液的PH值仍然相同,则M和N的关系是............................................................................................................ ( A )
2.对于0.1mol/LCH3COOH溶液,采用何种措施,能使醋酸的电离度减小而溶液的PH值增大的是( B)
A.加入一定体积的0.1mol/L的NaOH溶液 B.加入少量固体醋酸钠
C.加入等体积的水 D.加热
3.现有0.006%醋酸溶液,其电离度为10%,假设溶液的密度为1g/mL,则下列结论中正确的是 ( CD )
A.[H+]==10-3mol/L B.[OH-]==10-9mol/L
C.PH值==4 D.溶液中由水电离出的[H+]==10-10mol/L
4.把Ca(OH)2放入一定量的蒸馏水中,一定温度下达到如下平衡:Ca(OH)2(固)===Ca2++2OH-当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是..................................................................... ( AC )
A.溶液中Ca2+数减少 B.[Ca2+]增大
C.溶液PH值不变 D.溶液的PH值增大
5.50mL浓度为1mol/L的醋酸溶液与100mLNaOH溶液混合后,所得溶液的PH=7(常温下), 则对该溶液的有关叙述不正确的是................................................................................................................. ( A )
A.[Na+]==[CH3COO—] B.[CH3COO—]>[OH—]
C.原NaOH溶液的浓度为0.5mol/L D.原NaOH溶液的浓度大于0.5mol/L
6. 已知常温常压下饱和的二氧化碳的水溶液的PH 值==3.9, 则可推断用标准盐酸滴定NaHCO3水溶液时,适宜选用的指示剂及滴定终点时颜色变化的情况是................................................................ ( D )
A.石蕊 由蓝变红 B.甲基橙 由橙变红 C.酚酞 红色褪去 D.甲基橙 由黄变橙
7.PH值和体积相同的盐酸和醋酸分别跟锌反应,若其中一份溶液中有锌剩余,且两份溶液放出等量的气体,则下列判断中不正确的是........................................................................................................ ( C )
A.反应所需时间是盐酸大于醋酸
B.参加反应的锌的质量相等
C.盛醋酸溶液里锌有剩余
D.反应过程中,醋酸反应的平均速率大于盐酸反应的速率
8.常温下,测得0.100mol/L的某一元酸(HA)的PH值不等于1, 0.100mol/L的某一元碱(BOH)溶液中[H+]/[OH—]==10—12.将该两种溶液等体积混合,在所得的溶液中.............................................................. ( B )
A.[A—]>[B+]>[H+]>[OH—] B.[B+]>[A—]>[OH—]>[H+]
C.[B+]>[A—]>[H+]>[OH—] D.[A—]=[B+]>[H+]=[OH—]
9.同温度下的两种稀醋酸甲和乙,甲溶液的浓度为Cmol/L,电离度为α1,PH值为PH1,乙溶液中[H+]为Cmol/L,电离度为α2,PH值为PH2.则下列结论中不正确的是........................................................ ( D)
A.乙溶液中的[H+]是甲溶液中[H+]的1/α1
B.乙溶液中醋酸的物质的量浓度可表示为C/α2mol/L
C.α1>α2 D.PH 1 <PH2
10.在常温下,将PH=11的某碱溶液与PH=3的某酸溶液等体积混合,对此下列说法正确的是 ( AD )
A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐
B.若所得的溶液呈碱性,则可能是强碱与弱酸溶液反应
C.若所得溶液呈酸性,则可能是强酸与弱碱溶液反应
D.若所得溶液的PH=5,则可能强碱与弱酸溶液反应
11.在甲酸溶液中加入一定的NaOH溶液恰好完全反应,对于生成的溶液下列判断正确的是 ( )
A、[HCOO—]<[Na+] B、[HCOO—]>[Na+]
C、[OH—] <[HCOO—] D、[OH—] >[HCOO—]
12.25℃时,在0.1mol/LNaX的溶液中,水的电离度为α1,在0.1mol/L的盐酸中,水的电离度为α2,若α1/α2==109,则0.1mol/LNaX溶液PH值约为............................................................................... ( C )
A.4 B.7 C.10 D.13 C.
13. 下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+ 、Ba2+ 、Cl— 、SO42— B.K+
、AlO2— 、NO3— 、OH—
C.H+ 、NH4+
、Al3+ 、SO42— D.H+ 、Cl— 、CH3COO— 、NO3—
14.在-50℃液氨中有:2NH3==NH4+
+NH2—的电离平衡关系,两离子的平衡浓度均为1×10—15 mol/L ,下列对-50℃的液氨的离子积表达正确的是 ( BC )
A.离子积是1.0×10—15 B.离子积是1.0×10—30
C.此液氨中若放入NaNH2,其离子积不变
D.此液氨中放入氯化铵,则[NH4+]将增大,且离子积数值增加
15.在含有I—,且能使酚酞变红的无色溶液中,大量共存的离子组....................... ( B )
A.Na+ Cu2+ Br— B.Na + S2- SO32-
C.K+ MnO4— NO3— D.NH4+ Ca2+ AlO2— Na+
16.已知同温,同物质的量浓度的NaX溶液的PH值大于NaY溶液的PH值,据此,下列对两种对应酸(HX和HY)在相同温度和浓度下的比较中正确的是................................................................................ (AD )
A.[X—]<[Y—] B.电离度:HX>HY
C.HY溶液的PH值>HX溶液的PH值 D.HY溶液中的[H+]>HX溶液中的[H+]
17.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等同属离子型碳化物.请通过对CaC2制乙炔的反应进行的思考,从中得到必要的启示,判断下列反应产物正确的是.............................................................................. ( )
A. ZnC2 水解生成乙烷 B.Al4C3水解生成丙炔
C. Mg2C3水解生成丙炔 D. Li2C2水解生成乙炔 CD
18.有体积和PH值都相同的一元强酸溶液X和一元弱酸溶液Y,已知弱酸在此溶液中的电离度为0.5%,则X和Y中和同浓度氢氧化钠溶液的体积,Y是X的..................................................................... (B )
A.100倍 B.200倍 C.500倍 D.20倍
19、某强酸溶液的PH=a,强碱溶液的PH=b,已知a+b=12,酸碱溶液混合后PH=7,则酸溶液的体积V(酸)和碱溶液体积V(碱)的正确关系是:.............................................................................. ( )A
A、V(酸)=102V(碱) B、V(碱)=102V(酸)
C、V(酸)=2V(碱) D、V(碱)=2V(酸)
20、有五瓶溶液分别是:①10mL 0.60mol/LNaOH水溶液,②20mL 0.50mol/LH2SO4水溶液,③30mL0.40mol/LHCl水溶液,④40mL 0.30mol/LHAc水溶液,⑤50mL 0.20mol/L蔗糖水溶液,以上各瓶溶液中所含离子、分子总数的大小顺序是.................................................................................................................... ( )D
A、①>②>③>④>⑤ B、②>①>③>④>⑤
C、②>③>④>①>⑤ D、⑤>④>③>②>①
21、用水稀释0.1mol·L—1氨水时,溶液中随着水量的增加而减小的是......... ( )D
A、![]() B、
B、![]()
C、[H+]和[OH—]的乘积 D、OH—的物质的量
班级 姓名 成绩
选择题答题卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
| 21 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
二,填空题PH1+PH2=17,[R+]>A->OH->H+
22.有两瓶PH=12的碱溶液,一瓶是强碱溶液,一瓶是弱碱溶液。现有石蕊试液,酚酞试液,PH试纸和蒸馏水,而无其它试剂.简述如何用最简便的实验方法判断哪瓶是强碱?
23.25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)___________,其理由是_____________________
___________________________________________________________________________
(2)a值可否等于5(填“可”或“否”)___________,其理由是_____________________
____________________________________________________________________________
(3)a的取值范围是_______________________________________。
24.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A![]() H++HA— HA-
H++HA— HA-![]() H++A2—
H++A2—
已知相同浓度时的电高度a(H2A)>d(HA—),设有下列四种溶液:
A. 0.01mol.L-1的H2A溶液
B.0.01mol.L-1的Na2A溶液
C.0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
D.0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)[H+]最大的是______________________,最小的是______________________。
(2)[H2A]最大的是______________________,最小的是______________________。
(3)[A2—]最大的是______________________, 最小的是______________________。
三.计算题
25.常温下,有PH值为12的NaOH溶液100mL,若将其PH值变为11(设溶液的体积可以直接相加,计算结果保留到小数点后一位)。
(1) 若用PH=10的NaOH溶液,应加入__________mL
(2) 若用PH=2的盐酸,应加入_______mL
(3) 若用0.01mol·L—1的CH3COOH溶液V1mL,则V1的取值为________
(4) 若用PH=2的任意一元酸溶液V2 mL ,则V2的取值为_____________。
电解质溶液
1、A、B、B、B、B、B、B、B、D、A;2B、3CD、4AC、5A、6D、7C、8B、9D、10AD、11AC、12C、13B、14BC、15B、16AD、17CD、18B、19A、20D、21D、
24、(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3 (2)否,若a=5,![]() ,则b=10,
,则b=10,![]() ,
,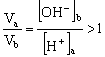 不符合题意,故a≠5 (3)
不符合题意,故a≠5 (3)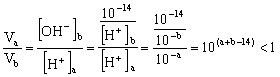 所以(a+b-14)<0,而a=0.5b
所以(a+b-14)<0,而a=0.5b
即![]() 又
又![]() 所以
所以![]()
24、(1)A,D (2)C,D (3)D,A
25、1000 mL,81.8 mL ,大于81.8 mL , 0<V2≤81.8
0.15mol/L