高考第一次全市统测(化学)试卷
第I卷(选择题,共72分)
可能用到的原子量:H —1 C —12 N —14 O— 16 Na— 23
Cl —35.5 S —32 Br —80 I—127 K—39
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.将如下卤化物跟浓H2SO4放在烧瓶中共热,可以得到纯净卤化氢气体的是( )
A NaF B NaCl C NaBr D NaI
2.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
3.下列实验中,仪器的下端必须插入液面下的是( )
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计
A ①③⑤ B ②④⑥ C ①③④⑤ D 全部
4.下列各组物质的性质比较,从强到弱的顺序正确的是( )
A 单质熔点:Li>Na>K>Mg>Al B 酸性:HClO4>H2SO4>H3PO4 >H2SiO3
C 稳定性:AsH3>PH3>NH3 D 沸点:HI>HBr >HCl>HF
5.用0.01mol·L-1NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液的体积最大的是( )
A 盐酸 B 硫酸 C 高氯酸 D 醋酸
6. 下列说法中,正确的是(用NA表示阿伏加德罗常数值)( )
A 常温常压下,1mol氖气含有的核外电子数是20NA
B 32g氧气和32g臭氧所含氧原子数都为2NA
C 18g水中所含的电子数是8NA
D 标准状况下,1L戊烷完全燃烧后生成的二氧化碳的分子数是5NA/22.4
7. 能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
A 铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B 铜锌合金在潮湿空气发生电化学腐蚀
C 用铜片作阴、阳电极,电解硫酸钠溶液
D 用铜片作阴、阳电极,电解硫酸铜溶液
8.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9. 晶体可以分为分子晶体、离子晶体、原子晶体等,在以下①②两个题目中,分别对不同晶体的组成、微粒间的作用力以及晶体的几何构型等进行了描述,请根据各题的提问做出选择:
①下列关于只含非金属元素的化合物的说法正确的是( )
A 一定是共价化合物,且只能构成分子晶体;
B 其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
C 其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
D 可能是离子化合物。
②有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
A 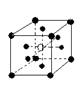 B
B 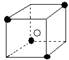 C
C 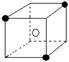 D
D 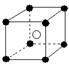
10.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A NaHSO4和Ba(OH)2 B Na2CO3和HCl
C NaAlO2和H2SO4 D Al2 (SO4)3和NaHCO3
11.某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是(
)
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平行混合物中三者的物质的量做如下调整,可使平衡右移的是(
)
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
12. 新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需要在高温下进行,在合成工艺中必须注意( )
A 通入充足的氧气 B 避免与氧气接触
C 可以在氮气气氛中合成 D 通入少量的氧气
13.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中以下各 正确的是( )
A C(NO3-)>C(OH-)>C(NH4+)>C(Ba2+)
B C(NO3-)>C(Ba2+)>C(OH-)>C(NH4+)
C [Ba2+]+[NH4+]+[H+]=[NO3—]+[OH—]
D 2[Ba2+]+[NH4+]+[H+]=[NO3—]+[OH—]
14.下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
A CH2=CH2、C2H5OH、HOCH2CH2COOH B CH2O、C2H4O2、C6H12O6
C C6H6、C5H10、C7H6O2 D H2、CO、CH3OH
15. 下列除去杂质的方法正确的是 ( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | I2 | / | 加热 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
16. 下列离子方程式中正确的是( )
A 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O
B NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O
C 苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
17.下列各组离子能在指定溶液中,大量共存的是( )
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使PH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
18. 某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是( )
A 升高 B 降低 C 不变 D 无法确定
第II卷(非选择题,共78分)
三、(本题包括2小题,共20分)
19.(12分) 在烧瓶A中放入一些新制的白色水硫酸铜粉末和约10mL酒精,锥形瓶B中盛放浓盐酸,分液漏斗C和广口瓶D分别盛浓硫酸,干燥管F中填满新制的碱石灰,用烧杯H作水浴器(如右下图)
打开分液漏斗C,将浓硫酸缓缓加进B,则D瓶的出气管口不断产生气体,几分钟后烧瓶A中的硫酸铜变蓝色,若此时用水浴加热,F端排出的气体待纯净后还能点燃,产生特殊颜色的火焰,已知C2H5OH沸点为78.5℃,C2H5Cl沸点为12.27℃,请回答:
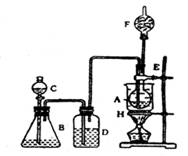 (1)B中逸出的气体是____________________
(1)B中逸出的气体是____________________
(2)D瓶的作用是________________________
(3)A瓶内硫酸铜的作用是________________
(4)E导管的作用是______________________
(5)F口可点燃的气体是__________________
(6)A中发生效应的化学方程式____________
20.(8分)将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系职下表所示:
| 组 别 | 1 | 2 | 3 |
| 盐酸体积(mL) | 50 | 50 | 50 |
| A的质量 (g) | 3.80 | 6.20 | 7.20 |
| 气体体积(mL) | 896 | 1344 | 1344 |
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
理由是
(2)试推断:A的成份为
四、(本题包括2小题,共18分)
21.(8分)
高温
反应①
![]()
高温
反应②
燃烧
反应③
常温下
反应④
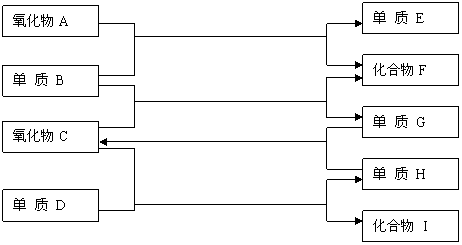
如上图,已知:
①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
⑴化合物F是 。⑵化合物I 是 。
⑶反应③的化学方程式是
⑷反应④的化学方程式是
22.(10分)如图,B为常见金属或非金属单质,有下列转化关系:
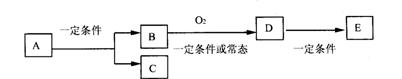
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是_________。
②若E是酸酐,且为易挥发的晶体,则A是________;D转化为E的一定条件是________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色。则A是_______;A、B、D、E中易溶于C的物质是_______(填字母)。
五、(本题包括2小题,共20分)
23.(10分)新型有机材料是近年来大量合成的一类新型化学材料。它具有密度小,强度高,弹性、可塑性、绝缘性和耐腐蚀性好等优点,因而被广泛用于工农业生产、交通运输、国防、医疗卫生、建筑以及日常生活。
(1)(3分)国际上最新采用热聚门冬氨酸盐(TPA)来降解聚丙烯酸的废弃物,TPA是由单体![]() 聚合而成,请写出TPA的结构简式
;
聚合而成,请写出TPA的结构简式
;
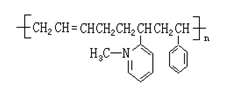 (2)(7分)新型弹性材料“丁苯吡橡胶”
(2)(7分)新型弹性材料“丁苯吡橡胶”
的结构简式如右图:其单体有 种,
结构简式为分别为:
|
![]()
|
一种用途较广泛的有机玻璃树脂——聚丁烯酸甲酯结构简式为: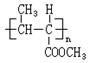 合成这种高聚物有多种途径,有一种合成途径其副产品污染少或无污染,原子利用率较高,因此符合“绿色化学挑战计划”的要求,其合成路线如下:
合成这种高聚物有多种途径,有一种合成途径其副产品污染少或无污染,原子利用率较高,因此符合“绿色化学挑战计划”的要求,其合成路线如下:
![]()
|
|
|
|
|
|
|
|
|
|
|
|
试解答下列问题:
(1)写出A—F代表的有机物结构式:A B C D E F
(2)在上述加成反应的过程中,原子利用率最高的化学反应有:
六、(本题包括2小题,共20分)
25.(8分)密闭容器中3.62gNaOH、Na2S、Na2SO3的混合物溶于50ml某浓度的稀H2SO4溶液中,不放出任何气体,再加入100ml0.1mol/L的Ba(OH)2溶液,正好中和过量的H2SO4,将反应所得的沉淀分离、洗净、烘干、称量,其质量为3.29g,求原混合物中各物质的物质的量之比?
26.(12分)已知在酸性条件下有如下关系:①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2;②Br2能氧化I—为I2;③KIO3能氧化I—为I2;④KIO3能氧化Br-为Br2。在③④反应中KIO3被还原为I2。试回答:
(1)KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序 。
(2)现取6 mL 0.4 mol·L—1KBrO3溶液和10 mL 0.4 mol·L—1KI溶液在稀H2SO4中混合,生成的产物是什么?物质的量之比为多少?
高考第一次全市统测(化学)答题卷
可能用到的原子量:H —1 C —12 N —14 O— 16 Na— 23
Cl —35.5 S —32 Br —80 I—127 K—39
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)(本题得分: )
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)(本题得分: )
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、(本题包括2小题,共20分)
(本题得分: )
19、(本小题12分)
(1)B中逸出的气体是________ ___; (2)D瓶的作用是________ _____;
(3)A瓶内硫酸铜的作用是______________; (4)E导管的作用是______________;
(5)F口可点燃的气体是_____ ____;
(6)A中发生效应的化学方程式_____ _______ 。
20.(本小题8分)
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
理由是 ;
(2)试推断:A的成份为 。
四、(本题包括2小题,共18分)
(本题得分: )
21.(本小题8分)
⑴化合物F是 。⑵化合物I 是 。
⑶反应③的化学方程式是
⑷反应④的化学方程式是
22.(本小题10分)
①则A是_________;
②则A是_____ __;D转化为E的一定条件是____ ____。
③则A是______ _;A、B、D、E中易溶于C的物质是_______(填字母)。
五、(本题包括2小题,共20分)
(本题得分: )
23.(本小题10分)
(1)TPA的结构简式 ;
(2)其单体有 种,
结构简式为分别为:
24.(本小题10分)
(1)写出A—F代表的有机物结构式:A B C
D E F
(2)在上述加成反应的过程中,原子利用率最高的化学反应有:
六、(本题包括2小题,共20分)
(本题得分: )
25.(本小题8分)
26.(本小题12分)
高考第一次全市统测(化学)参考答案
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | C | A | B | D | B | C | A |
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | DB | AD | C | BC | BD | AC | A | AC | C | A |
三、(本题包括2小题,共20分)
19、(本题12分)
(1)B中逸出气体为氯化氢; (2)干燥氯化氢; (3)检验有水生成;
(4)冷凝乙醇,减少乙醇损失; (5)是C2H5Cl
(6)C2H5OH+HCl![]() C2H5Cl+H2O
C2H5Cl+H2O
20、(本题8分)
(1)上表中第 (1) 组数据加入的50mL盐酸的反应后有剩余,
理由是:第一组生成的气体最少,而2、3组生成的气体一样多,假如1组中盐酸不足,则生成气体的体积应由盐酸决定,1、2、3产生的气体体积就应是相同的,假如2组中盐酸是过量的则,2、3组所生成的气体就不能相同,所以可以判断出1组中盐酸是过量的。
(2)试推断:A的成份为 NaOH与Na2CO3或Na2CO3与NaHCO3。 。
四、(本题包括2小题,共18分)
(本题得分: )
21.(本小题8分)
⑴化合物F是 CO(一氧化碳) 。⑵化合物I 是 HF(氟化氢) 。
⑶反应③的化学方程式是 2H2+O2=2H2O
⑷反应④的化学方程式是 2F2+2H2O=4HF+O2
22.(本小题10分)
①则A是_____NaCl____;
②则A是____H2S_ __;D转化为E的一定条件是 催化剂、加热。 。
③则A是___CH3CH2OH____;A、B、D、E中易溶于C的物质是_ A、D、E____(填字母)。
五、(本题包括2小题,共20分)
23.(本小题10分)
(1)TPA的结构简式 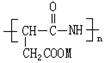 ;
;
(2)其单体有 3 种,
结构简式为分 ![]()
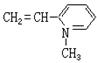
![]()
24.(本小题10分)
(1)A:CH≡CH B: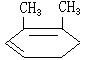 C:CH3COCH2COOH D:
C:CH3COCH2COOH D:![]()
E:CH3CH=CHCOOH F:CH3CH=CHCOOCH3
(2)①③⑥
六、(本题包括2小题,共20分)
(本题得分: )
25.(本小题8分)
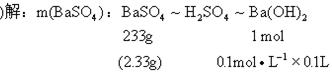
![]()
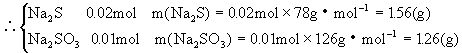
![]()
26.(本小题12分)
(1)I2<Br2<KIO3<KBrO3
(2)所得产物为Br2、I2 、IO3—、H2O,物质的量之比为3∶3∶4∶6。