高考化学理论部分综合练习(一)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.有下列物质:①白磷 ②金刚石 ③石墨 ④二氧化硅 ⑤甲烷 ⑥四氯化碳 ⑦单晶硅 ⑧铵根离子,其分子结构或晶体结构单元中存在正四面体的是
A.除③外 B.只有①②⑤⑥ C.除③⑧外 D.除③④⑦⑧外
2.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为
 A.XY B.XY2
C.XY3 D.X2Y3
A.XY B.XY2
C.XY3 D.X2Y3
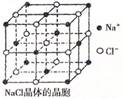
3.纳米材料的表面微粒占总微粒数的比例极大,这是纳米材料
具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和
形状恰好与氯化钠晶胞的大小和形状(如图所示)相同,
则这种纳米颗粒的表面微粒数占总微粒数的百分数为
A.87.5% B.92.9%
C.96.3% D.100%
4.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是 ①电子数 ②最外层电子数 ③电子层数 ④次外层电子数 其中正确的是
A ①② B ②③ C ③④ D ①④
5.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述
① c(A-)=c(K+) ② c(H+)=c(OH-)<c(K+)<c(A-)
③ V总≥20mL ④ V总≤20mL 其中正确的是
A.①③ B.②④ C.①④ D.②③
6.以 NA 表示阿佛加德罗常数,下列说法正确的是
A.10.6gNa2CO3 固体中,含 0.1NA个CO 32 -
B.1摩尔甲基中含有7 NA个电子
C.31g 白磷中含有 NA 个 P - P 键
D.2g 重氢中含有2 NA个质子
7.美国Lawtcce Lirermre国家实验室(LLNL)的V·Lota·C·S·Yoo和H·Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是
A.CO2的原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2的原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2的原子晶体中,每一个碳原子周围结合4个氧原子,每一个氧原子跟两个碳原子相结合
8.膦(PH3)又答为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述中,正确的是
A.PH3是非极性分子 B.PH3分子中有未成键的电子对
C.PH3是强氧化剂 D.PH3分子中的P—H键是非极性键
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.A、B、C为短周期的三种元素,A、B处于同周期,A、C的最低价离子分别为A2-、C-、A2-的离子半径大于C-,B2+与C-具有相同的电子层结构。以下叙述不正确的是
A.原子半径:A>B>C B.原子序数:A>B>C
C.离子半径:A2->C->B2+ D.最外层电子数:C>A>B
![]() 10.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断不合理的是
10.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断不合理的是
A.c1∶c2=1∶3 B.平衡时,Y和Z的生成速率之比为3∶2
C.X、Y的转化率不相等 D.c1的取值范围为0<c1<0.14mol·L-1
11.某元素的离子R2+有5个电子层,最外层有2个电子,当RCI2固体配成溶液时,为得到澄清溶液并防止变质,常在溶液中加入少量R单质和盐酸,下列叙述正确的是
A.R为IIA族元素 B.R的最高价氧化物的对应水化物是强碱
C.R2+的硝酸盐水溶液呈中性 D.RCI2有还原性,可进一步被氧化
|
A.用惰性电极电解MgCl2溶液2Cl-+2H2O Cl2↑+H2↑+2OH-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:
Ca2++2HCO3-+2OH- CO32-+CaCO3↓+2H2O
C.次氯酸钙溶液中通入过量的CO2:
Ca2++3ClO-+H2O+CO2 CaCO3↓+2HClO
D.氢氧化铁溶于碘化氢溶液:Fe(OH)3+3H+ Fe3++3H2O
13.镍的氧化物晶体中,由于n(Ni):n(O)<1,所以晶体结构存在缺陷,通常表示成Ni0.97O。则标明镍价态的该晶体的化学式是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
14.VCD光盘上的光记材料有多种,其光记原理为在激光照射下发生物理变化或化学变化从而记录储存信号,碲(Te)的某种化合物是常见的一种VCD光记录材料,下列关于碲及其化合物的叙述不正确的是
A.单质碲是一种银白色的固体 B.元素位于元素周期表中第五周期ⅥA族
C.碲酸的酸性比硫酸强 D.碲化氢不如硫化氢稳定
15.X、Y、Z为短周期元素,X元素原子核内无中子,Y元素原子核外最外层电子数是次外层电子数的两倍,Z元素是地壳中含量最多的元素,这三种元素可能组成的物质的化学式为
①X2YZ ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3
A.①②③④ B.②⑤ C.②④⑥ D.②⑤⑥
16.下列各选项所述的两个量,前者一定大于后者的是
①F2和Br2的沸点 ②纯水在25℃和80℃时的pH值 ③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量 ④25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+离子半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②④⑥ B.①②③⑤ C.⑤⑥⑦⑧ D.②⑥⑦
17.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始现现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。其平衡关系如下:
![]()
![]() Cr3++3OH-
Cr(OH)3 CrO2-+H++H2O
Cr3++3OH-
Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入1.0mol·L-1的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
18. 某二元弱酸的酸式盐NaHA溶液,若pH<7则溶液中各离子的浓度关系不正确的是
A. c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—)
B. c(Na+)+ c(H+) = c(HA—)+2c(A2—)+ c(OH—)
C. c(H+)+ c(A2—)= c(OH—) + c(H2A)
D. c(Na+)=== c(HA—)+ c(H2A)+ c(A2—)
三、简答填空(24分)
19.(8分)有A、B、C、D四种元素,它们的原子序数由A至D逐渐增大,D的氢化物分子式为H2D,D在最高价氧化物中质量分数为40%,而且D的原子核内质子数和中子数相等;A和B原子有相同的电子层数。A原子的最外层电子数是次外层电子数的2倍;B的阴离子、C的阳离子和Ne原子的电子层结构相同。通常状况下B的单质是气体,0.1 molB的单质和H2充分反应时,有2.408×1023个电子转移;C的单质在高温下与B的单质充分反应可得淡黄色固体,此生成物与AB2反应可生成B的单质,由以上叙述回答:
(1)C、B单质反应生成的淡黄色固体的电子式为_____________。AB2结构式为 ,分子的空间构型为 , AB2的晶体属于 晶体。
(2)淡黄色固体与AB2反应可生成B的单质的化学方程式为
(3)C和D组成的化合物溶于水,溶液并不显中性的原因是(用离子方程式稀释):
。
20.(8分)已知反应AsO43-+2I-+2H+![]() AsO33-
+I2+H2O是可逆反应.现设计如图2-33所示的实验装置,A烧杯中装有Na3AsO4和Na3AsO3溶液,B烧杯中装有I2和KI溶液.两烧杯用一倒置的装有饱和氯化钾的U形管相连,此装置称为盐桥。其作用是避免两烧杯中的电解质溶液相混合,又使两烧杯中的电解质溶液能导电。C1、C2为惰性电极,现进行如下操作:a.向B溶液中滴入浓盐酸,发现电流计指针发生偏转.b.若改向B溶液中滴入40%的氢氧化钠溶液,发现电流计指针向相反方向偏转.试回答下列问题:
AsO33-
+I2+H2O是可逆反应.现设计如图2-33所示的实验装置,A烧杯中装有Na3AsO4和Na3AsO3溶液,B烧杯中装有I2和KI溶液.两烧杯用一倒置的装有饱和氯化钾的U形管相连,此装置称为盐桥。其作用是避免两烧杯中的电解质溶液相混合,又使两烧杯中的电解质溶液能导电。C1、C2为惰性电极,现进行如下操作:a.向B溶液中滴入浓盐酸,发现电流计指针发生偏转.b.若改向B溶液中滴入40%的氢氧化钠溶液,发现电流计指针向相反方向偏转.试回答下列问题:
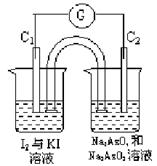 (1)电流计指针为什么能发生偏转
(1)电流计指针为什么能发生偏转
。
(2)两次操作中,电流计指针的偏转方向为什么相反?用化学平衡原理解释。
(3)写出a操作中C1棒上和 b操作中C2棒上发生的电极反应方程式。
a操作中C1棒 b操作中C2棒
21. (8分)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度远 大于第二步的电离程度,第二步的电离程度远大于第三步电离程度。……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA+HC2-(少量)=A-+H2C-
②H2B(少量)+2A-=B2-+2HA
③H2B(少量)+H2C-=HB-+H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子的是 ,最难结合质子的是 。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A.H3C+3A-=3HA+C3- B.HB-+A- =HA+B2- C.H3C+B2-=HB-+H2C-
(4)完成下列反应的离子方程式
A.H3C+OH-(过量):
B.HA(过量)+C3-
四、实验设计(15分)
22.(5分)已知Ag(NH3)2+不太稳定,在溶液中存在如下的离解平衡:Ag(NH3)2+![]() Ag+2NH3,所以需用过量的氨水才能溶解某些含Ag+的沉淀物.今有两份固体混合物A、B,它们分别由Al2(SO4)3、AgCl、AgNO3、BaCl2、NH4Cl、NH4NO3、KOH、Na2S中的两种或三种组成.某同学为确定A、B的组成进行了如下的实验:分别取A、B各少许,各加入适量的蒸馏水充分振荡,都只得无色溶液;分别取无色溶液各少许,各滴加稀硝酸,都有白色沉淀生成.试回答:
Ag+2NH3,所以需用过量的氨水才能溶解某些含Ag+的沉淀物.今有两份固体混合物A、B,它们分别由Al2(SO4)3、AgCl、AgNO3、BaCl2、NH4Cl、NH4NO3、KOH、Na2S中的两种或三种组成.某同学为确定A、B的组成进行了如下的实验:分别取A、B各少许,各加入适量的蒸馏水充分振荡,都只得无色溶液;分别取无色溶液各少许,各滴加稀硝酸,都有白色沉淀生成.试回答:
(1)A、B的可能的组合是什么?
(2)试设计实验继续确证A、B的组成,简述有关的操作、现象和结论.
23.(10分)请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
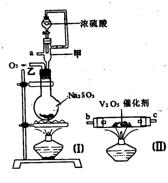
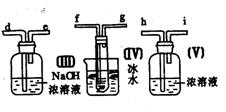
(1)这些装置的连接顺序(按气体从左到右的方向)是____→ ____→__ →_____→____→____→___→____→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是______________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
五、计算推理(15分)
24.(5分)超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下,生命作代谢过程产生的超氧离子(O2-)才不致过多积存而毒害细胞使人过早衰老。
|
![]() _ O2- + _
_ O2 + _ H2 O2
_ O2- + _
_ O2 + _ H2 O2
(2) 含有SOD的浓度为c0 (E)=0.400×10-6 mol/L,pH=9.1溶液中,对该反应进行研究,在常温下测得不同超氧离子的起始浓度c0(O2-)下,超氧化物歧化反应的起始反应速率Vo如下:(mol·L-1·s-1)
| c0(O2-) (mol/L) | 7.96×10-6 | 3.33×10-5 | 2.00×10-4 |
| V0 (mol·L-1·s-1) | 3.85×10-3 | 1.67×10-2 | 0.100 |
已知该歧化反应在常温下的速率方程可表示为:Vo =k [c0(O2-)]n。试根据测定数据确定歧化反应的反应级数:
n= ,化学反应速率常数k=_____________。
25.(10分)在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g);△H<0
2NH3(g);△H<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答:
哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5摩氩气,则N2的转化率会起什么变化?正反应速度与原平衡相比,有无变化,简答理由。
(3)若在1升定容容器中,上述反应达到平衡时,平衡混和物中N2、H2、NH3的物质的量分别为A、B、C摩。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),应满足的条件是:
①若x=0,y=0,则z= ,
②若x=0.75,则y应为 mol、z应为 mol。
③x、y、z应满足的一般条件是 。
理论部分综合练习(一)
参考答案
| 1 | A | 2 | A | 3 | C | 4 | D | 5 | C |
| 6 | A | 7 | D | 8 | B | 9 | A | 10 | C |
| 11 | D | 12 | B | 13 | A | 14 | C | 15 | A |
| 16 |
| 17 | C | 18 | C |
| |||
19.(1) O=C=O 直线型 分子晶体。
(2)2Na2O2+2CO2==2Na2CO3+O2
(3)S2-+H2O==HS-+OH- HS-+H2O==H2S+OH-
20.(1)两次操作均构成了原电池。(2)分析:电极反应也可逆C1棒:2I--2e-![]() I2
,C2棒:AsO43-+2e-+2H+
I2
,C2棒:AsO43-+2e-+2H+![]() AsO33-
+H2O;若在A容器中加酸,则平衡向正反应方向移动,若在A容器中加碱,则平衡向逆反应方向移动。 (3)电极反应为:C1棒: 2I--2e= I2 ,C2棒:AsO33- -2e-+H2O
= AsO43- +2H+ 。
AsO33-
+H2O;若在A容器中加酸,则平衡向正反应方向移动,若在A容器中加碱,则平衡向逆反应方向移动。 (3)电极反应为:C1棒: 2I--2e= I2 ,C2棒:AsO33- -2e-+H2O
= AsO43- +2H+ 。
21. (1)H2B (2)C3-HB- (3)B、C
(4)A:H3C+3OH-=C3-+3H2O B:2HA+C3-=2A-+H2C-
22.(1)组成一:Al2(SO4)3和过量的KOH的混合物。
组成二:AgCl和NH4NO3以及过量的KOH。
(2)继续滴加稀硝酸至过量若白色沉淀溶解,原混合物为组成一;若白色沉淀不溶解,原混合物为组组成二。
23. (1) a h i b c f g d
(2) 使浓H2SO4顺利滴入烧瓶。
(3)先加热催化剂后滴浓H2SO4 。
(4)无色针状晶体。
(5)减小;混合气温度高,不反应放热,来不及氧化,平衡向逆反应方向移动。
(6)1-![]()
24.(1)2O2 - + 2H+ = O2 + H2O2;(2)n=1;k=500
25.(1)定压容器、定压容器。
(2)N2的转化率以及正反应速度都降低。理由是:由于反应容器保持定压,所以当加入氩气后,反应容器的容积会增大,这样使得反应容器中的各物质的浓度降低,所以正反应速度降低(逆反应速度也降低),从反应物及产物的系数可以看出,反应物的系数比产物的系数大,所以,容器容积增大对正反应速度降低的效果更为明显,故平衡向逆反应方向移动,使N2的转化率降低(答出要点即可)
(3)①2 ②2.25 0.5 ③3x=y 2x+z=2(其它合理答案都正确)。