高三年级实验班化学实验练习题(二)
1. 称取四份0.50克锌(原子量65),按下列要求分别盛于四支试管,塞L带导管的塞子,每隔一定时间分别测定生成氢气的体积。
(1) 0.50克锌+5毫升3摩/升硫酸
(2) 0.50克锌+5毫升3摩/升硫酸+0.1克铜片
(3) 0.50克锌+5毫升3摩/升硫酸+0.1克铜粉
(4) 0.50克锌十5毫升3摩/升硫酸+0.41克胆矾(相当于 0.1克铜)
请把实验现象填入下表,并对实验现象作简要的说明:
| 序号 | 生成氢气的速度* | 生成氢气的总量** |
| (1) | ||
| (2) | ||
| (3) | ||
| (4) |
*请分别填入:“慢”“快”“最快”“最慢”或其他;**请分别填入:“相等”“最多”“最少”或其他
2. 现有一瓶稀氨水,要测定NH3·H2O电离度的大约数值,其实验方案可设计如下:
(1) 先做 实验(写名称,不用写过程),目的是 ,所需的主要药品是 与 。
(2) 再测定其pH值,其操作过程简述如下
(3) 设上述氨水的物质的量的浓度为c,测得的pH值为a,求该氨水的电离度a。
3. 在用氢气还原氧化铜的实验后,有人做了以下实验:
①将一部分还原后得到的红色固体加浓硝酸,红色固体逐渐溶解,有红棕色气体生成,溶液呈蓝色。
②将另一部分红色固体加足量的4摩/升硫酸溶液,轻轻振荡,经足够长的时间以后,溶液呈蓝色,还有相当多的紫红色固体未溶解。
根据上述实验现象回答或填空:
(1) 解释在实验①中产生红棕色气体及溶液变蓝的现象(用简要的文字和化学方程式说明该现象)
(2) 解释实验②中紫红色固体不溶的现象。
(3) 解释实验②中溶液变蓝的原因。
(4) 由上述分析可以得知氧化铜被氢气还原可能分两步进行,写出这两步反应的化学方程式。
3. 有1、2.3、4号四瓶未知溶液,它们是:NaCl(0.1mol/L)、HCl(0.1mol/L)、NaOH(0.1mol/L)、酚酞(0.1%),有人不用其它试剂,就把它们—一鉴别开来了。其实验步骤如下:
(1) 各取少许溶液两两混和,据此分成两组;
(2) 取一组混和液,不断滴入另一组中的一种未知液,据此可鉴别出1号和2号;
(3) 再取已鉴别出的1号2mL,滴入3滴3号未知液,再加4号未知液4mL,在这个过程中无明显实验现象。
综合以上实验,可以确认1号是 ,2号是 ,3号是 ,4号是 。
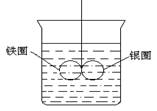 4. 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
4. 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
(1) 片刻后观察到的现象是(指金属圈)__________.
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态不变
C. 铁圈向下倾斜
D. 银圈向下倾斜
(2) 产生上述现象的原因是
.
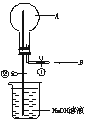 5. 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中观察的现象并按要求书写反应的化学方程式:
5. 如图所示,在一个烧瓶中充满气体A,打开①处的止水夹并向烧瓶中缓慢通入等体积的气体B后关闭该止水夹,待充分反应后再打开②处的止水夹。请按要求填表回答打开②处的止水夹前后烧瓶中观察的现象并按要求书写反应的化学方程式:
(1) 填写下列表格:
| 实验 | 气体A | 气体B | 现 象 | A与B反应 的化学方程式 | |
| 打开②处止水夹前 | 打开②处止水夹后 | ||||
| ① | SO2 | H2S | ———— | ||
| ② | NH3 | HCl | |||
| ③ | O2 | NO | |||
 (2) 分别完成以上三个实验后,烧瓶内剩余气体最多的是(填实验序号) 。
(2) 分别完成以上三个实验后,烧瓶内剩余气体最多的是(填实验序号) 。
6. 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途:
(1) 医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从 (填标号,下同)管口通入。
(2) 实验室用MnO2与浓HCl反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,先将Cl2从装置 管口导进,从 管口导出,此时,该装置所起的作用是防止NaOH溶液倒入流入反应器。
(3) 当用此装置收集NO时,应采取的主要操作步骤是:
① ②
7. 某学生要用浓硝酸法(测定反应生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外,还会有少量NO生成; ②常温下NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体(或晶体)存在。为完成测定并验证确有NO生成,该学生设计的实验装置如下图,试回答:
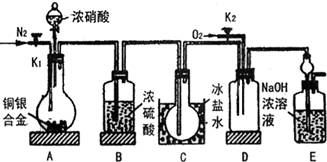
(1) 实验前要先打开A装置的活塞K1,通入一段时间氮气后再关闭K1其目的和原因是 。
(2) 装置B的作用是 。
(3) 实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入 (填“冷”或“热”)的氧气,其原因是(用所学过的理论知识解释):
___________________________________________________________________.
(4) 为减小测量误差,在A中反应完成和D中出现现象后,还应进行的操作是:
(5) 若设反应中硝酸无挥发也无分解,且溶液的体积变化忽略不计,实验已测得以下数据:铜银合金的质量、浓硝酸的物质的量浓度及体积(过量)、E装置反应生成物中氮元素的质量;为确定合金中铜的质量分数,还需测定的数据是:
______________________________________________________.
(6) 若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需简单实验操作(不使用B—E连续装置)就可达目的,简述实验过程:
.
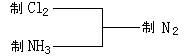 8. 某探究性学习小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路:
8. 某探究性学习小组在查阅资料中发现,常温下氯气可以氧化氨气获得氮气。该小组由此设计出制取氮气的思路:
实验室现有如下试剂及仪器(见图):
试剂: ①饱和食盐水 ②浓硫酸 ③浓硝酸 ④浓盐酸 ⑤碱石灰 ⑥二氧化锰 ⑦浓氨水
仪器:
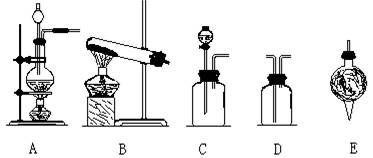
请完成下列各题:
(1) 写出制取N2的化学方程式 ,反应生成0.5mol N2,转移的电子数是 mol。
(2) 用以上仪器(可重复使用)连接成制纯净C12、NH3的装置,按照前后顺序把图的编号填入下表中,并写出对应仪器里试剂的编号。(下列空格不一定填满)
| 制Cl2 | 仪器 | |||
| 试剂 | ||||
| 制NH3 | 仪器 | |||
| 试剂 |
(3) 当反应装置里的氨气和氯气的物质的量之比大于 时,尾气里一定含有氨气:当反应装置里的氯气和氨气的物质的量之比大于 时,尾气里一定含有氯气。
[1] (1)最慢 相等 (2)慢 相等 (3)快 相等 (4)最快 最少 (2)(3)(4)比(1)快是因为Zn-Cu原电池,(3)(4)比(2)快Cu面积大,(4)比(3)快是Cu面积更大,均匀。 (4)中发生Zn置换少量Cu2+的反应。
[1] (1)中和滴定 测定氨水的物质的量的浓度 标准盐酸 甲基橙试液 (2)用洁净的玻璃棒蘸取氨水,滴在pH试纸上,将试纸与标准比色卡相比较,从而测定此氨水的pH值 (3)该氨水的电离度a=10α-14/c×100%
[1] (1)略 (2)生成的铜不溶于稀硫酸,而氧化亚铜在酸性条件下发生歧化反应也有铜生成:Cu2O+H2SO4=Cu+CuSO4+H2O (3)Cu2O+H2SO4=Cu+CuSO4+H2O,生成的CuSO4溶液呈蓝色 (4)略
[1] D Fe和Ag构成原电池,Fe极Fe溶解,Ag极Cu析出增重。
[1] HCl NaCl NaOH 酚酞
[1] (1)
| 实验 | 气体A | 气体B | 现 象 | A与B反应 | |
| 打开②处止水夹前 | 打开②处止水夹后 | ||||
| ① | SO2 | H2S | ———— | 产生喷泉 | SO2+2H2S=3S+2H2O |
| ② | NH3 | HCl | 大量白烟 | 产生喷泉 | NH3+HCl=NH4Cl |
| ③ | O2 | NO | 无色变为红棕色 | 产生喷泉 | 2NO+O2=2NO2 |
(2)③
[1] (1)排尽整个装置中的空气;防止生成的NO被氧化,而在D中观察不到现象。 (2)吸收所流中的水蒸气。 (3)无色气体变为红棕色 热 由题意可知2NO2![]() N2O4是放热反应,升高温度可使平衡向吸热方向(逆向)移动,无色的N2O4减少,红棕色NO2增多,便于观察。(或降温可使平衡正向移动,无色N2O4增多,NO2减少,不易观察到红棕色 (4)打开K1、K2持续通入一段时间的N2和O2 (5)装置C中烧瓶在实验前后增加的质量 (6)向反应后的混合溶液中加入过量的NaCl溶液,过滤、洗涤、干燥沉淀,称量生成的AgCl沉淀质量,然后进行计算。(其它合理答案均给分)
N2O4是放热反应,升高温度可使平衡向吸热方向(逆向)移动,无色的N2O4减少,红棕色NO2增多,便于观察。(或降温可使平衡正向移动,无色N2O4增多,NO2减少,不易观察到红棕色 (4)打开K1、K2持续通入一段时间的N2和O2 (5)装置C中烧瓶在实验前后增加的质量 (6)向反应后的混合溶液中加入过量的NaCl溶液,过滤、洗涤、干燥沉淀,称量生成的AgCl沉淀质量,然后进行计算。(其它合理答案均给分)
[1] (1)a (2)b a (3)①集气瓶中先充满水 ②将NO从b管口导入
[1] (1)2NH3+3Cl2=6HCl+N2(或8NH3+3Cl2=6NH4Cl+N2) 3 (2)A D D ④⑥ ① ② C(或A) E ⑤⑦(或⑦) ⑤ (3)8/3 3/2