高三年级实验班化学实验练习题(四)
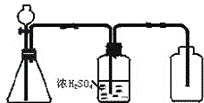 1. (1)下图是一套实验室制气装置,用于发生干燥和收集气体,下列各组物质中能利用这套装置进行实验的是 (填代号)。
1. (1)下图是一套实验室制气装置,用于发生干燥和收集气体,下列各组物质中能利用这套装置进行实验的是 (填代号)。
①亚硫酸钠和硫酸 ②二氧化锰和浓盐酸 ③电石和水 ④石灰石和稀硫酸 ⑤锌和稀硫酸 ⑥硫化亚铁与稀硫酸 ⑦乙醇与浓硫酸
(2)有两瓶失去标签的物质的量浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①下列试剂中,可选用的一种试剂是_________(填代号)。
A. 氢氧化钠溶液 B. 甲基橙溶液 C. 稀盐酸 D. 澄清石灰水
②除上述方法外,你认为是否还有最简单的方法_________。
(3)实验室需要用纯净的NaCl溶液,现有的NaCl晶体中混有少量的Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微热好?你选择的是___________,其理由是_______________________________________________________ 。
判断是(NH4)2CO3已除尽的方法是 。
②以下是除去SO42-的实验方案,请在( )中填写试剂的名称,在[ ]中填写操作方法。
C操作中所使用的玻璃仪器的名称是 ,证明SO42-已经沉淀完全的方法是 。
2. 氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。
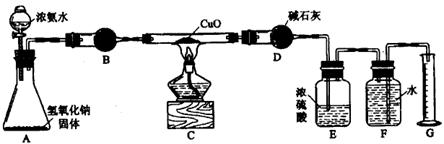
(1) 写出氨气与氧化铜反应的化学方程式 。
(2) 在A的锥形瓶中放入NaOH固体的目的是 。
(3) 在干燥管B里不能选用的干燥剂是(填序号) 。
A. 碱石灰 B. 生右灰 C. 五氧化二磷 D. 氢氧化纳
(4) 在C的玻管中观察到的现象是 。
(5) E装置中盛装浓硫酸的目的是 。
(6) 待实验完毕后,若实验测得N2的体积(折算成标准状况)为止,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(7) 上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减少”或“无影响”) ,理由是 。
3. 下图中A是H2发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U形管,D是装有还原铁粉的反应管。实验前先检查实验装置 的气密性。实验开始时,先关闭活塞W,并取下烧瓶B;向A中加入一定量浓度的盐酸适量,产生H2。经必要的操作后,在导管的出口处点燃氢气,然后如图所示套上烧瓶,塞紧瓶塞,氢气在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞W,B瓶中的气体通过U形管后在D中反应,进入E,最后进入F中(F中装有某种物质的溶液,作检验之用)。
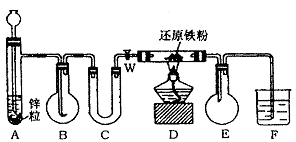
请回答下列问题:
(1) 实验前如何检查装置气密性?
(2) 点燃H2前必须进行什么操作?为什么?
(3) 写出B、D中分别发生反应的化学方程式。
B中 。
D中 。
(4) U形管中,应盛试剂是 ,其作用是 。
(5) E装置作用是 。
(6) F中可装 的溶液,发生的现象为 。
4. 实验室用氨气还原氧化铜的办法测定铜的近似相对原子量,反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1) 如果选用反应物CuO和生成物H2O质量(mH2O,mCuO)时,请用下列仪器设计一个简单的实验方案。
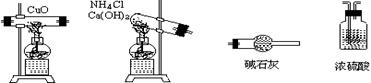
a b c d
①仪器连接顺序(用字母编号表示,仪器可重复使用) 。d中浓硫酸的作用是: 。实验完毕时观察到a中的现象是: 。
②列出计算Cu的原子量的表达式:铜的原子量=
③下列情况将使测定结果偏大的是
(a) CuO未被全部还原 (b) CuO受潮 (c) CuO中混有Cu
(2) 如果仍采用上述仪器装置,其它方案可选用测定的物理量有
(a) mCuO和mCu (b) mN2和mH2O (c) mNH3和mH2O
5. 在加热的条件下用NH3还原CuO可以制得纯净的N2和活性铜粉(途径I);用该活性铜粉与空气反应又制得较纯净的N2(途径II)。由于N2在实验室制备常需要用到有毒和易使人致癌的NaNO2,上述方法因CuO与Cu的循环使用,且制出的N2可基本满足要求,故倍受人们关注。下面给出了按途径I和途径II制N2必需的几种实验仪器,其它必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等仪器均未列出。请按下列要求填写空白:
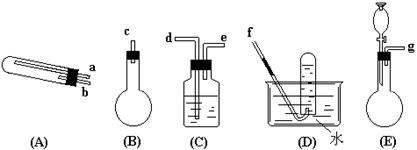
(1) 按途径I制N2时用浓氨水作原料至少需要用到上述仪器中的哪些仪器?(请按气流从左到右顺序列出仪器序号) ;
(2) 按途径II制N2时,至少需要用到上述仪器中的哪些仪器?(请按气流从左到右顺序列出仪器序号的接口顺序) ;
(3) 按途径Ⅰ制N2时你所选定的仪器组装的装置中,实验时需要加热的仪器序号是 ;
(4) 按途径Ⅱ制N2时,原料气(空气)是通过向 中加入 而送入反应器的;
(5) 为了保证途径I制得的N2比途径Ⅱ制得的N2纯净,是在仪器 中加入 以除去杂质气体
(6) 写出在仪器(A)中所发生的化学方程式: 。
(7) F处的棉花应蘸取的物质是 ,其作用是 。
6. 实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题:
30℃时几种盐的溶解度(克/100克水)
| NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2SO4 | (NH4)2SO4 | CaCl2 | MgCl2 | CaSO4 |
| 36.3 | 27.0 | 41.4 | 11.1 | 40.8 | 78.0 | 51.7 | 26.2 | 0.165 |
制备纯碱的主要步骤如下:
①配制50毫升约25%的粗食盐水(密度近似为1克/厘米3);
②精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调节至7;
③加热食盐水,将溶液温度控制在30—35℃;
④在不断搅拌下,分数次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、搅拌半小时;
⑤静置,趁热过滤,回收母液,晶体用蒸馏水洗涤两次;
⑥将晶体灼烧,得到纯碱。
(1) 步骤①中,配制溶液的最后一步操作是 〖说明:用不着容量瓶、用不着定容,因为该过程不需要非常精确:“配制50毫升约25%的粗食盐水”〗
(2) 步骤②中,SO42-是否需要除去? ,理由是 ;
(3) 步骤④中所有操作的共同目的是 ;
(4) 步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 〖注意:是“杂质阳离子”;Ca2+、Mg2+在精制的过程中已经除去,而Na+不是杂质离子〗,在通常情况下,检验这种阳离子的方法是 。
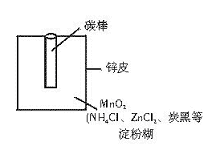 7. 某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
7. 某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
(1) 干电池的基本构造和工作原理。
上图为干电池的基本构造图。干电池工作时负极上的电极反应式是 。
正极上的电极反应式是___________(已知NH4+的得电子能力大于Zn2+)。
MnO2作去极剂(吸收正极放出的H2,防止产生极化现象),该反应方程式为:H2+2MnO2=Mn2O3+H2O。而淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
正极产生的NH3又和ZnCl2溶液作用:Zn2++4NH3=[Zn(NH3)4]2+
(2) 锌皮和碳棒的回收。用钳子和剪刀剪开回收的干电池的锌铜,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。
(3) 氯化铵、氯化锌的提取、检验和分离。
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤:
②设计简单的实验证明所得晶体中含有NH4+。
实验步骤:
实验现象:
有关的离子方程式: 。
③用什么方法可将NH4Cl和ZnCl2的晶体混合物分离开? 。
(4) 最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器有 。
[1] (1)① (2)①C ②用pH试纸分别测定两溶液的pH (3)①加热;因加热操作方便、简单,试剂节省且又不引入新的杂质;加盐酸看是否有气泡或加消石灰加热,用湿润的红色石蕊试纸鉴别(其他合理答案均可) ②BaCl2;Na2CO3;过滤;盐酸;漏斗、玻璃杯、烧杯;取pH=7的溶液加BaCl2 后看是否有白色沉淀生成。
[1] (1)2NH3+3CuO![]() N2+3Cu+3H2O (2)NaOH的强碱性及溶解产生的热利于氨气的逸出。 (3)C (4)黑色粉末变为光亮的红色固体。 (5)将反应剩余的氨吸收。 (6)3a/22.4 9a/11.2b (7)减小,D装置吸收的水中包含了从A中带出的水份。
N2+3Cu+3H2O (2)NaOH的强碱性及溶解产生的热利于氨气的逸出。 (3)C (4)黑色粉末变为光亮的红色固体。 (5)将反应剩余的氨吸收。 (6)3a/22.4 9a/11.2b (7)减小,D装置吸收的水中包含了从A中带出的水份。
[1] (1)关闭W,用手握住E瓶,或微热D管,若F中导气管处有气泡排出,松开手或停止加热,导气管中有一段水柱上升,证明W→F气密性好。 在A中,从长颈漏斗处加水至浸没长颈漏斗下口端(液封),再关闭W,用手握住烧瓶B(或微热B),若A中水沿长颈部分上升一段水柱,松手或停止加热后,水柱回落,证明A→W部分气密性好。 (2)用一小试管集满H2后,移近火焰,若听到尖锐的爆鸣声,证明气体不纯;若只听到轻微“噗”的声响,证明H2纯净。 (3)B中:2H2+O2=2H2O D中:N2+3H2![]() 2NH3 (4)碱石灰;除去HCl和水蒸气 (5)防止水倒吸进入D中加热的试管中,兼收集NH3的作用 (6)酚酞溶液;溶液由无色变成红色
2NH3 (4)碱石灰;除去HCl和水蒸气 (5)防止水倒吸进入D中加热的试管中,兼收集NH3的作用 (6)酚酞溶液;溶液由无色变成红色
[1] (1)①bcacd 吸收未反应的氨气,防止空气中的水分进入c装置 固体由黑色变为红色 ②18mH2O/mCuO-16 ③(a)(c) (2)(a)(c)
[1] (1)BACD或EACD (2)gabf (3)BA或(E)A (4)E或分液漏斗 蒸馏水或水 (5)C 浓硫酸 (6)2NH3+3CuO=N2+3Cu+3H2O2Cu+O2=2CuO
[1] (1)用玻璃棒搅拌 (2)不需要 除去Ca2+、Mg2+后,在溶液所控制的温度下,可能存在的硫酸盐的溶解度都比碳酸氢钠大,且SO42-含量小,过滤以后会留在母液中,不会被结晶下来; (3)使生成碳酸氢钠的反应充分进行 (4)NH4+ 取少量待检液倒入试管,滴入少量NaOH溶液,在试管中搁一张润湿的红色石蕊试纸,加热,观察试纸是否会显兰色
[1] (1)Zn-2e-=Zn2+ 2NH4++2e-=2NH3↑+H2↑ (3)①向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。 ②实验步骤:取少量晶体溶于蒸馏水配成溶液。取少许溶液,加入少量NaOH溶液后加热,将湿润的红石蕊试纸放在试管口 实验现象:试纸变蓝 有关离子方程式:NH4++OH-![]() NH3↑+H2O ③加热法 ④坩埚、酒精灯(玻璃棒、三脚架)等
NH3↑+H2O ③加热法 ④坩埚、酒精灯(玻璃棒、三脚架)等