高三普通化学单元试卷-----《硅和硅酸盐工业》
班级: 姓名: 学号: 成绩
参考原子量:C-12,O-16,H-1,Si-28, Ca-40, Fe-56, Na-23, S-32
一、选择题
1.下列各组物质中不起反应的是
A.SiO2与纯碱共熔 B.CO2通入Na2SiO3溶液
C.SiO2与大理石共熔D.SiO2和浓H2SO4共热
2.二氧化硅比二氧化碳熔点高得多的原因是
A. 二氧化硅比二氧化碳的键能大
B.二氧化硅是原子晶体,二氧化碳是分子晶体
C.二氧化硅比二氧化碳式量大 D.二氧化硅比二氧化碳分子间作用大
3.关于硅的化学性质的叙述中,正确的是
A.常温时不和任何酸反应 B.常温时硅与卤素单质均不反应
C.单质硅比金刚石熔点低 D.单质硅比碳的非金属性强
4.用一种试剂证明生石灰中含有石灰石和石英,下列试剂适宜的是
A.盐酸 B.硫酸钠 C.NaOH溶液 D.氯化钠溶液
5.将45g SiO2与 75gCaCO3共热,生成CO2的质量为
A.54g B.45g C.33g D.39.6g
6.在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
7.光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A 碳 B 石英 C 锗 D 硅
8与钢化玻璃成分相同的是
A 有色玻璃 B 普通玻璃 C 石英玻璃 D 光学玻璃
9.下列物质:①水泥 ②玻璃 ③陶瓷 ④水晶,其中属于硅酸盐工业产品的是
A 只有①② B 只有②④ C 全部 D 只有①②③
10.将固体烧碱熔化,应选择的坩埚是
A 石英坩埚 B 瓷坩埚 C 铁坩埚 D 玻璃坩埚
11、能用磨口塞玻璃瓶存放的试剂有:
A. 烧碱溶液 B. 浓硝酸 C. 氢氟酸 D. 硅酸钠溶液
12.下列哪些材料是新型无机材料
① 氧化铝陶瓷 ② 氮化硅陶瓷 ③ 碳化硅陶瓷 ④ 氮化铝陶瓷
⑤ 氮化钛陶瓷 ⑥ 硅化硼陶瓷 ⑦ 二硅化铜陶瓷
A ①②③ B ①③④⑤ C ①⑤⑥ D 全部
13.高岭土的组成可表示为Al2Si2Ox(OH)y,其中x、y的数值分别是
A 7,2 B 5,4 C 6,3 D 3,6
14.在碳族元素中,从上到下逐渐减小或减弱的是
A、 原子的价电子数 B、气态氢化物的稳定性
C.单质的还原性 D、原子半径
15.下列几种酸中,酸性最弱的是
A、碳酸 B、硅酸 C、磷酸 D、高氯酸
16.、下列物质属于纯净物的是
①水玻璃 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水 ⑦液氯
A、①④ B、①⑤ C、①⑤⑥ D、⑤⑦
17、下列叙述中正确的是
A、因为胶体微粒带有电荷,所以胶体显电性
B、丁达尔效应可区别胶体和浊液
C、胶体微粒直径大小介于10-9~ 10-7cm之间
D、胶体微粒不能透过半透膜
18.由10g含有杂质的CaCO3和足量盐酸反应,产生了0.11molCO2,推断杂质的组成可能是 ( )
(1) .KHCO3和MgCO3 (2) .K2CO3和Na2CO3
.(3) .MgCO3和SiO2 (4) .Na2CO3和NaHCO3
A.(3)(4) B.(1)(2)(3) C.(2)(3)(4) D.(1)(3)
19.将过量的CO2通入下列溶液中,最终出现沉淀的是 ( )
(1) .CaCl2溶液 (2) .石灰水 (3) .饱和Na2CO3 (4) .水玻璃
A. (1) (3)(4) B. (2)(3) C.(3)(4) D.(1)(3)
20、下列各组物质的熔点均由高到低排列,其原因是由于键能由大到小排列的是( )
A.钠、铝、干冰 B.金刚石、碳化硅、晶体硅
C.碘化氢、溴化氢、氯化氢 D.二氧化硅、二氧化碳、一氧化碳
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
二、填空题
21.在碳族元素中,非金属性最强的元素是_______,金属性最强的元素是_______,单质能作半导体的元素是_______,+2价最稳定的元素是 ,气态氢化物最稳定的是_______,最高氧化物水化物酸性最强的是________。
22.工业上制造普通玻璃的主要原料是 、 、_____,
主要原料熔化后,发生的主要化学反应是(1) ,(2) 。普通玻璃的成份是 。
23.滑石[Mg3(Si4O10)(OH)2]改写为氧化物形式表示可写成____________。
24.工业上制取粗硅的化学反应式是 。
25.硅化氢(SiH4)在空气中能自燃,根据甲烷燃烧的化学方程式,写出硅化氢自燃的化学方程式 。此反应中硅化氢是 (得到,失去)电子,作为 剂。
26.原硅酸通过分子间缩水聚合可形成不同的多硅酸(多聚体),如:
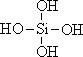
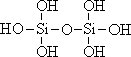
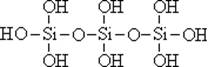
原硅酸 二聚体 三聚体
 则原硅酸的化学式是 ,原硅酸二聚体的化学式是 , 按上述规律,n个原硅酸聚合而成的链状多酸分子的通式是 。
则原硅酸的化学式是 ,原硅酸二聚体的化学式是 , 按上述规律,n个原硅酸聚合而成的链状多酸分子的通式是 。
三、实验题
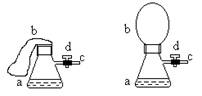
27.图(1)中瓶a内放入20毫升6摩/升盐酸,b是未充气的气球,里边放有4克碳酸钙粉未,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图(1)的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为W2克.则W2和W1的关系是 .
(2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是 .
![]()
不再溶解.此时瓶内温度 (填"不变"、"降低"或"升高").
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式 .
四、给下列方程式配平
(1)S + KNO3 + C = K2S + N2 + CO2
(2)Cu + FeCl3 = FeCl2 + CuCl2
五、计算题
1.现有一硅钢片(只含Fe、Si),将其投入足量盐酸中或足量NaOH溶液中,放出的气体质量相同,则硅钢片中硅的质量分数是多少?
2、将18.4克晶体硅与过氧化钠的混合物投入到足量的水中,充分反应后,将收集到的气体点燃并恢复到室温,发现无气体剩余。
(1)求原混合物中晶体硅的质量。
(2)向剩余的溶液中通入足量的CO2气体,并将其小心地加热蒸发,可得固体多少克?