高三化学元素及化合物综合测试题与答案
(一)选择题(每小题只有一个正确选项)
1.粗盐易潮解的原因是 [ ]
A.NaCl易吸水
B.NaCl易溶于水
C.Na+易与H2O结合生成水合Na+
D.含的杂质易潮解
2.下列物质中既不能用浓H2SO4干燥,也不能用碱石灰干燥的是 [ ]
A.Cl2
B.H2S
C.CO2
D.NH3
3.下列叙述错误的是 [ ]
A.工业盐酸显黄色,是由于其中含有少量Cl2
B.久置的碘化钾溶液显黄色,是由于I-被氧化成I2
C.浓硝酸显黄色,是由于硝酸分解生成的NO2溶于硝酸中
D.皮肤上沾上浓硝酸后显黄色,是由于浓硝酸与蛋白质发生
了硝化反应
![]()
正确的是 [ ]
A.过氧化钡的化学式是Ba2O2
B.过氧化钠和过氧化钡都是强氧化剂
![]()
D.1mol过氧化钠或过氧化钡与足量的水反应都生成1mol氧气
5.某固体X与硝酸反应生成溶液Y,Y与过量的NaOH反应得沉淀Z,经过过滤后的沉淀物进行加热,又转变为X,则X可能是①BaO,②FeO,③Al2O3,④CuO中的 [ ]
A.①②
B.①②③
C.②③④
D.只有④
6.下列物质中能使品红溶液褪色的是 [ ]
①干燥的氯气,②Na2O2,③NaClO,④活性炭,⑤SO2
A.只有②④⑤
B.只有②③⑤
C.只有①②⑤
D.全部都可以
7.把等物质的量的Na、Na2O、Na2O2、NaOH分别置于足量的同体积水中,所得溶液物质的量浓度的关系正确的是 [ ]
A.Na2O2 >Na2O>Na>NaOH
B.Na2O=Na2O2>Na=NaOH
C.Na2O=Na2O2 >Na>NaOH
D.Na2O>Na2O2>NaOH>Na
8.下列溶液中,在空气里既不易被氧化,也不易分解,且可以用无色玻璃试剂瓶存放的是 [ ]
A.石炭酸
B.氢硫酸
C.氢氟酸
D.醋酸
9.在下列四种溶液里,分别加入少量MnO2固体,能产生气体的是 [ ]
A.3%H2O2溶液
B.1mol/L NaOH溶液
C.1mol/L KClO3溶液
D.1mol/L盐酸
10.关于 ⅠA和 ⅡA族元素的下列说法中正确的是 [ ]
A.在同一周期中,ⅠA族单质的熔点比ⅡA族的高
B.浓度都是0.01mol/L时,氢氧化钾溶液的 pH比氢氧化钡
的小
C.氧化钠的熔点比氧化镁的高
D.加热时,碳酸钠比碳酸镁易分解
(二)选择题(每小题有一至两个正确选项)
![]()
4NO2↑+O2↑。现将18.8gCu(NO3)2加热使之完全分解,将产生的气体用排水法收集。下列叙述正确的是 [ ]
A.收集不到任何气体
B.能收集到O2
C.能收集到NO
D.若所得溶液为1L,其浓度为0.2mol/L
12.向溶有8gNaOH溶液中通入一定体积(标准状况)的CO2,将反应后所得溶液在减压下蒸干,得13.7g白色粉末(不含结晶水)。则通入CO2的体积为 [ ]
A.2.84L
B.3.36L
C.3.65L
D.4.00L
13.有Na2S和Na2SO3的混合物30g。用足量的稀H2SO4处理后,生成9.6g硫,则原混合物中Na2S的质量可能是 [ ]
A.15.6g
B.17.4g
C.12.6g
D.11.7g
14.把 1g含脉石(SiO2)的黄铁矿样品在氧气中灼烧,反应完全后得残渣0.78g,则此黄铁矿中S元素的质量百分比为
[ ]
A.35%
B.48%
C. 66%
D. 78%
15.工业上用氨的催化氧化法制HNO3,现有17tNH3气,若全部转化为HNO3,最少需要氧气 [ ]
A.16t
B.24t
C.32t
D.64t
16.下列物质中,既可与盐酸反应,又可与NaOH溶液反应的是 [ ]
①NaHCO3 ②(NH4)2S ③Al2O3 ④Al(OH)3 ⑤Al⑥H2NCH2COOH
A.只有④
B.只有③④⑤⑥
C.只有①④⑤
D.全部都可以
17.下列物质中能跟镁起反应并生成氢气的是 [ ]
A.甲酸溶液
B.氢氧化钠溶液
C.氯化铵溶液
D.碳酸氢钠溶液
18.下列各组溶液,不用其它试剂就可以将它们区别开的是 [ ]
A.HCl、KOH、K2SO4、K2CO3
B.NaNO3、HCl、NH4Cl、KOH
C.BaCl2、CaCl2、Na2SO4、KNO3
D.KOH、K2CO3、MgSO4、KHSO4
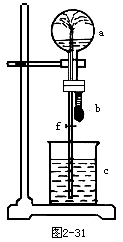
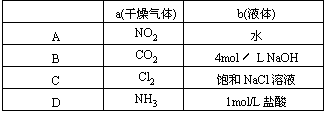
19.在图2-31装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是 [ ]
20.下列各组中的三种物质,第一种物质跟酸反应生成沉淀或变浑浊,第二种跟碱反应生成气体,第三种跟水反应生成沉淀和气体,符合上述实验事实的是 [ ]
A.Na2S2O3溶液、NH4Cl溶液、Al2S3固体
B.C6H5ONa溶液、Al粉、Mg3N2固体
C.KAlO2溶液、AlCl3溶液,CaC2固体
D.Na2SiO3溶液、Si粉、Na2O2固体
21.下列关于硬水的叙述中,正确的是 [ ]
A.含有Ca2+和mg2+ 的水叫做硬水
B.加热煮沸暂时硬水,可以降低水的硬度
C.永久硬水无法软化
D.利用磺化煤(离子交换剂)处理后的硬水Na+含量增加
22.将铁粉和氧化铁粉同时投入到一足量的稀H2SO4中,充分反应后取其溶液,加入少量NH4SCN溶液后无明显现象。下列说法正确的是 [ ]
A.Fe粉与 Fe2O3粉的物质的量之比一定是 1∶1
B.Fe粉与 Fe2O3粉的物质的量之比是≥1∶1
C.反应后的溶液中可能存在Fe2+、Fe3+、H+等
D.反应后的溶液中:[H+]+2[Fe2+]=2 [SO42-]+
[OH-]
23.将Na2O2投入 FeCl2溶液中,可观察到的现象是 [ ]
A.生成白色沉淀
B.生成红褐色沉淀
C.有气泡生成
D.无变化
24.为了使鱼苗顺利运输,必须满足3个条件:①需要保持适量的氧气,②使鱼苗呼出的CO2及时排出,③防止细菌大量繁殖
已知下述四种物质加入水中都可起到供氧灭菌的作用,过氧化钙微溶于水,生成氢氧化钙和氧气。在长距离储运鱼苗的水中,最好加入 [ ]
A.过氧化钠
B.氯水
C.过氧化钙
D.双氧水
25.某无色气体含有CO、CO2、NH3、HCL、H2和H2O气中的一种或几种,当它依次通过澄清石灰水,氢氧化钡溶液、浓硫酸、灼热的氧化铜、无水硫酸铜(假定每处均完全作用)后,所产生的现象依次为:无浑浊,浑浊,无变化,变红,变蓝。则下列结论正确的是 [ ]
A.肯定有CO2、HCl,可能有NH3和H2或其中之一
B.肯定有H2、CO2、HCl,可能有CO和H2O气
C.肯定有H2,肯定没有CO2
D.肯定有CO、CO2、H2,可能有HCl
(三)选择题(每小题只有一个正确选项)
26.根据下列事实,判断离子的氧化性顺序为 [ ]
①A+B2+=A2++B,②D+2H2O=D(OH)2+H2↑,③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e= E,B-2e=B2+
A. D2+> A2+> B2+> E2+
B.D2+> E2+> A2+> B2+
C.E2+>B2+>A2+>D2+
D.A2+>B2+>D2+> E2+
27.下列物质所发生的化学反应中,由于反应物的用量不同,而得到不同的产物的是 [ ]
①H2S+O2 ②P+Cl2 ③NaCl(固)+H2SO4(浓) ④P2O5+H2O ⑤ CH3CH2OH+浓 H2SO4 ⑥ Na2CO3+ HCl ⑦Cu+HNO3
A.全部都是
B.①②⑥
C.③④⑤⑥
D.①②⑥⑦
28.过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫
![]()
后,含有示踪原子的物质是 [ ]
A.氧气
B.水
C.硫酸钾
D.硫酸锰
29.常温下,向 20L真空容器中通入 a molH2S和 b molSO2(a、b都是正整数,且a≤b,b≤5),反应完毕后,容器内气体可能达到的最大密度约是 [ ]
A.24.5g/L
B.14.4g/L
C.8g/L
D.5.1g/L
![]()
![]()

A.该鉴定可在酸性或碱性溶液中进行
B.该鉴定只能在中性溶液中进行
C.AgNO3必须过量
D.S2-对该鉴定有干扰
(四)填空题
31.某待测液可能含有Fe3+、Fe2+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子。进行了下述实验(所加试剂均过量):
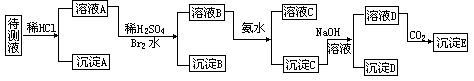
(1)判定待测液中有无Ba2+、Ca2+,并说明理由________________________。
(2)加Br2水的作用是____________________。
(3)写出沉淀C与NaOH溶液反应的离子方程式_____________。
(4)沉淀D的分子式为_______________。
(5)生成沉淀E的离子方程式为___________。
32.甲、乙、丙、丁4种化合物都是由短周期元素A、B、C、D、E中的两种元素组成。在常温常压下,甲为气体,乙为液体,丙和丁为固体。元素A、B、C、D、E的原子序数依次增大, A、D同主族, B、 E同主族,B、C同周期。甲是由A、 C组成,原子个数比为1∶1;乙是由A、B组成,原子个数比为1∶1;丙是由B、D组成,丙是1种强氧化剂,可以用来漂白织物等;丁是由D和E组成的离子化合物,阴离子比阳离子多1个电子层。由此判断这4种化合物的化学式分别为:甲______,乙_________,丙_______,丁________。丙的电子式为_________。
33.已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠。现以硫化亚铁为主要原料,按下图制取硫代硫酸钠。图中A、B、C、D是硫单质或硫的化合物,其它不含硫的反应物已被略去,各步反应可以添加必要的试剂。
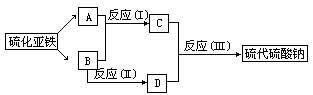
(1)反应(I)的化学方程式为___________。
(2)D的分子式为____________,硫代硫酸钠的分子式为_______________。
(3)硫代硫酸钠与稀H2SO4反应生成C,反应的离子方程式为_______________。
34.说明:某金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
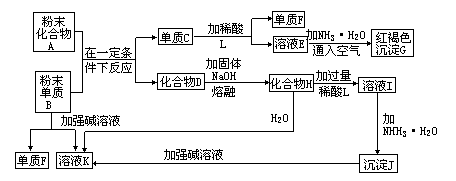
(1)单质F是_________。
(2)写出由E生成C的离子反应方程式(或化学方程式)_______________________________________________
________________________。
(3)溶液I中所含的金属离子是___________________。
(4)由C—→E+F,若改用浓酸,则不能选用的浓酸是(写分子式)_________________________。
35.A、B、C是常见的三种化合物,各由两种元素组成,转化关系如下图。

(1)在A、B、C中,必定含有乙元素的是_______。
(2)单质乙必定是_________(填“金属”或“非金属”);其理由是_________________。
(3)单质乙的分子式可能是________,则化合物B的分子式为____________。
36.将0.1mol铁粉和0.05mol硫粉均匀混合后,铺在石棉网上加热引燃,完全反应后,将残渣全部放入过量的稀H2SO4中充分反应。结果所产生的气体的体积在标准状况下明显少于2.24L,其主要原因是_______________。
37.在碘化钾和硫酸的混合溶液里,加入过氧化氢(H2O2),放出大量不溶于水的无色气体(现象是从溶液内部析出大量的小气泡),同时溶液呈现红棕色,可使淀粉变蓝。用化学反应方程式说明发生此现象的原因______________。
38.在一定条件下可实验下图所示物质之间的转化:填写下列空白:
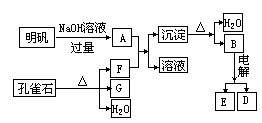
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中F是____________。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:____________________。
(3)图中所得G和D都为固体,混合后在高温下可发生反应,该反应的化学方程式为________________。
(4)每生成1molD,同时生成________molE。
(五)计算题
39.为了将10.0mL硫酸和硝酸的混合溶液完全中和,共消耗浓度为2.38mol/L的Ba(OH)2溶液16.8mL,同时生成7.00g沉淀。
(1)计算原溶液中每种酸的物质的量浓度。
(2)将原溶液与2.0g铜粉共热时能生成多少升(标准状况下)气体?(Cu的原子量取63.5)
40.已知NH4+与HCHO在水溶液中有如下反应:4NH4++6HCHO→(CH2)6N4+4H++6H2O现有一失去标签的铵盐,为了测定其含氮量,称取2g样品溶于水,加入少量HCHO溶液配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入0.1mol/L NaOH溶液,当滴到 25mL时溶液出现粉红色,且在半分钟内未褪去。求该铵盐中氮的百分含量。
参考答案
(一)1.D
2.B
3. A提示:是由于含Fe3+。
4. B提示:过氧化钡的化学式为BaO2;O22-具有强氧化性,所以过氧化物都是强氧剂,如K2O2、Na2O2、BaO2、
![]()
成 0.5molO2。
5.D提示:Ba(OH)2易溶于水;FeO与HNO3反应后生成 Fe3+,后转化成Fe(OH)3、Fe2O3;Al(OH)3溶于过量 NaOH。
6.D
7.C
8.D
9. A提示:MnO2加入到KClO3溶液中时不能起催化作用,也不能与稀盐酸(1mol/L)反应,本题考查对反应发生条件的把握的准确程度。
10.B提示:金属越活泼熔点越低;Na2O与MgO的熔点取决于晶体中离子键的强弱,Mg2+的电荷高且半径小,所以离子键强,熔点高,Na2CO3与MgCO3熔点比较原理亦如此。
(二) 11.A D
12.B
13.A B 解:因2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+
![]()
![]()
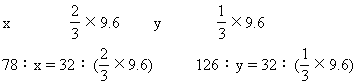
解得 x=15.6(g) y=12.6(g)
因15.6+12.6<30 所以必有一种物质过量
若Na2SO3过量,则 Na2S为 15.6(g)
若Na2S过量,则Na2S为30-12.6=17.4(g)
14.A
15.D
16.D
17.A、C
18.A、D提示:A组各试剂的鉴别方法是:根据将HCl逐滴滴入K2CO3中,开始无气泡,滴到一定量时有气泡产生;若将K2CO3滴入盐酸中立即有气泡产生。可判断出 HCl、K2CO3溶液。将K2CO3溶液分别滴入另外两种溶液中,然后分别向两种溶液中滴入盐酸,先产生气泡的是K2SO4和K2CO3的混合液,则另外一种是KOH和K2CO3的混合液(因HCl先要中和KOH)。
19.B、D提示:要明确形成喷泉的原理;产生内外压强差。要想充满烧瓶,气体要几乎完全被吸收。
20.A、B
21.B、D
22.B、D
23.B、C提示:Na2O2有强氧化性可将 FeCl2氧化成 FeCl3。
24.C
25.B
(三)26.C
27.B
28.A
29.B 提示:当a=1,b=5时,反应后容器内的压强最大。
30.A
(四)31.(1)含Ba2+、Ca2+中的一种或两种,因为BaSO4不溶,Ca-SO4微溶
(2)将Fe2+氧化成Fe3+
(3)Al(OH)3+OH-=AlO2-+2H2O
(4) Fe(OH)3
(5)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
![]()
33.(1)2H2S+SO2=3S↓+2H2O
(2)Na2SO3;Na2S2O3
(3)S2O32-+2H+=S↓+SO2↑+H2O
34.(1)H2
(2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或 Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al3+和Na+
(4)H2SO4(或 HNO3)
提示:由B(单质) ![]() F(单质),可判定B是Al(或Zn、Be、 Si等),F是H2,G为红褐色沉淀,所以G为Fe(OH)3,则A是铁的氧化物(A与B发生铝热反应),C是Fe,E含Fe2+,D是Al2O3,它与NaOH反应表现其酸性。各物质的转化关系如下图:
F(单质),可判定B是Al(或Zn、Be、 Si等),F是H2,G为红褐色沉淀,所以G为Fe(OH)3,则A是铁的氧化物(A与B发生铝热反应),C是Fe,E含Fe2+,D是Al2O3,它与NaOH反应表现其酸性。各物质的转化关系如下图:
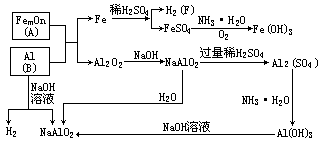
(F)
35.(1)A、B(2)非金属; A+B→2+C,所以乙在 A、B中必有正负价(3) S(或N2);H2S(或NH3)
36.高温下部分铁粉转化为与稀硫酸作用不产生气体的氧化物。
37.2H2O2=2H2O+O2↑
H2O2+2KI+H2SO4=I2+2H2O+K2SO4
38.(1)CO2(2)Al3++4OH-=AlO2-+2H2O
![]()
(五)39.解:(1)OH-+H+=OH-
10mL中共含H+:0.0168×2×2.38=0.08(mol)
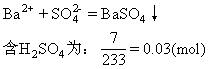
含HNO3为:0.08-0.03×2=0.02(mol)
所以:[H2SO4]=0.03/0.01=3(mol/L)
[HNO3]=0.02/0.01=2(mol/L)
(2)由于有H2SO4的存在,在与Cu反应时HNO3只作氧化剂3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
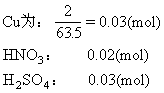
故恰好反应,生成0.02mol NO
VNO=0.02×22.4=0.448(L)
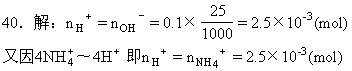
即 10mL溶液中含2.5×10-3 mol,那么100mL溶液中含NH4+的物质的量为2.5×10-2mol,也就是2g样品中含NH4+ 的量。
NH4+~N
1 14
![]()
2.5×10-2x 所以x=0.35(g)
![]()