高三化学总复习试题(3)
第I卷
1.白云母是重要的无机硅酸盐材料,它的主要成分为K2Al6Si6(0H)nO18,则n为( )
A 4 B 6 C 8 D 10
2,我国及美国,日本等国家都已研制出了一种陶瓷柴油机。这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料制造的,这种材料是( )
A氧化铝陶瓷 B氮化硅陶瓷 C光导纤维 D钠玻璃
3.科学家根据自然界存在的N2制取出N3,其后又陆续制取出N5+离子的化合物及其N60。N5极不稳定,需保存在-80℃的干冰中。 N5+离子由于其极强的爆炸性,又称为“盐粒炸弹”。N60与C60结构相似,在受热或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。分析上述材料,下列说法中不正确的是( )
A N5常温下会剧烈爆炸,体积急剧膨胀,放出大量的热
B N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料
C N2,N3,N5,N5+,N60互为同素异性体
D 含N5+离子的化合物中既有离子键又有共价键
4.下列物质能使品红溶液褪色得是( )
①活性炭②过氧化钠③次氯酸钠④SO2⑤干燥的氯气
A除①外都可以 B除⑤外都可以 C只有②③④可以 D全部都可以
5.煅烧黄铁矿时损失了x%的硫元素,则FeS2的损失率与硫元素的损失率比较:( )
A 大于x% B 小于x% C 等于x% D 不能确定
6.近年用红外激光技术研究液氢,发现分子间作用力也可以引起微粒间反应,已知在液氢中由氢分子和质子形成H3+,其构型为正三角形,同时H3+和氢分子可进一步形成Hn+,下列有关判断不正确的是:( )
A在液氢中有2H2![]() H3++H-过程发生,故液氢有微弱的导电性。
H3++H-过程发生,故液氢有微弱的导电性。
B H3+在液氢中可以形成H4+ ,H6+ ,H8+
C H3+在液氢中可以形成H5+ ,H7+ ,H9+
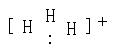 D H3+的电子式为
D H3+的电子式为
7.下列说法,违反科学原理的是:( )
A碘化银可用于人工降雨 B闪电时空气中的N2可转变为氮的化合物
C添加少量某物质可将水变成燃料油 D在一定温度,压强下石墨可以变成金刚石
8.现有四瓶失去标签的无色溶液,只知他们是苯,四氯化碳,亚硫酸钠溶液,氯化镁溶液。下列试剂中,不能鉴别上述药品的试剂是( )
A 溴水 B NaOH溶液 C BaCl2溶液 D K2SO4溶液
9.A.B均为原子序数1-20的元素,已知A的原子序数为n,A2+比B2-少8个电子,则B的原子序数为( )
A n+4 B n+6 C n+8 D n+10
10.X和Y都是短周期元素,它们可形成aXn- (n<4 =和bYm+两种简单离子。已知aXn-比bYm+多两个电子层,且a-b+n+m=10,则符合题意的X元素有:( )
A 3种 B 4种 C 5种 D 6种
11.下列存放药品的方法正确的是( )
A少量的白磷存放在煤油中
B苛性钠存放在带玻璃塞的广口瓶中
C液溴保存在无色配有橡皮塞的玻璃瓶中
D浓硝酸,硝酸银存放在带玻璃塞的棕色细口瓶中
12.下列叙述中不正确的是( )
A 电解池的阳极发生氧化反应,阴极发生还原反应
B 原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C 电镀时,电镀池里的阳极材料发生氧化反应
D电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
13、科学家发现半胱氨酸[HS—CH2—CH(NH2)—COOH]能增强艾滋病毒感染者的免疫力,对控制艾滋病毒的蔓延有奇效。则下列说法错误的是( )
A、半胱氨酸属于![]() —氨基酸
B、半胱氨酸是一种两性化合物
—氨基酸
B、半胱氨酸是一种两性化合物
C、两分子半胱氨酸脱水形成的二肽结构简式为
HS—CH2—CH(NH2)—COO—S—CH2—CH(NH2)—COOH
D、HS—CH2—CH(NH2)—COONH4可以和NaOH溶液反应放出一种碱性气体
14、某温度下,将Cl2通入NaOH溶液,反应后得到NaCl、NaClO、NaClO3的混合物。经测定ClO-与![]() 的浓度之比为1 : 3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为( )
的浓度之比为1 : 3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A、21 : 5 B、11 : 3 C、3 : 1 D、4 : 1
15.Mg、Al、Fe三种金属的混合物与足量的稀硫酸反应,生成2.80LH2(标准状况)则三种金属的物质的量之和不可能是 ( )
A、0.120mol B、0.150 mol C、0.0800 mol D、0.100 mol
16.10.8克氮的氧化物NxOy和50克灼热的铁在密闭真空容器中反应一段时间后,生成0.1molFe3O4和0.1molN2。则NxOy是( )
A NO B N2O3 C NO2 D N2O5
17.一些元素分别跟碳硅形成化学键,键能数据如下表(单位:KJ/mol)依照这些数据,判断下列叙述正确的是( )
| Si | C | H | Cl | O | |
| Si | 210 | 250 | 323 | 391 | 368 |
| C | 250 | 356 | 416 | 327 | 336 |
A金刚石的熔点低于硅
B硅化氢比甲烷难在氧气中燃烧
C SiCl4比CCl4易于从单质化合而成
D碳单质形成二氧化碳比硅单质形成SiO2容易
18.在一定温度下CuSO4在水中的溶解度为25g,该温度下将32gCuSO4粉末投入m g水中形成饱和溶液,并有CuSO4·5H2O晶体析出,则m的取值为( )
A 36g<m<128g B 18g<m<128g
C 36g<m<180g D 128g<m<180g
第Ⅱ卷(非选择题)
19.某同学做如下实验:第一步:将一定量的氧化铜粉末加入到稀H2SO4中,微热,待氧化铜完全溶解,得到蓝色溶液;第二步:向上述蓝色溶液中加入mg铁粉,充分反应后过滤,将所得固体进行干燥并称量,得质量为ng。
(1)若硫酸适量(氧化铜完全反应后无硫酸剩余)时,m和n的关系式为:_______________
(2)若硫酸过量(氧化铜完全反应后有硫酸剩余)时,m和n的关系可能有 种情况,关系式分别为
(3)在第(2)种情况m和n可能的关系中,任选一种情况加以分析。
20.已知:2Fe3++2I-=2Fe2++I2 2Fe2++Br2=2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2溶液中通入2 mol Cl2,此时被氧化的离子是 ,被氧化的离子的物质的量分别是 。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是 ____________ ,其对应的氧化产物的物质的量分别是________________ 。
(3)若向含![]() mol FeI2和
mol FeI2和![]() mol FeBr2溶液中通入
mol FeBr2溶液中通入![]() mol Cl2,当I-、Fe2+、Br-完全被氧化时,c的范围是:
(用含a、b的代数式表示)。
mol Cl2,当I-、Fe2+、Br-完全被氧化时,c的范围是:
(用含a、b的代数式表示)。
21、将Cl2通入NaBr溶液,充分反应后,进行溴的萃取和分液操作,下列A组为萃取和分液的操作;B组为各步操作所要达到的目的,试将A组的各步操作按正确的操作顺序编号(用1、2、3…表示),将序号填入括号内;同样将B组编号,使每一叙述与A组的各步操作相符合。
| A 组 | B 组 |
| ( )把分液漏斗放在铁架台上,静置片刻 | ( )使下层水溶液漫漫流出 |
| ( )右手压住漏斗口部,左手握住活塞部分,将漏斗倒转并振荡 | ( )使漏斗内外空气相通,保证漏斗内液体能流出 |
| ( )打开漏斗下端活塞,待下层液体流尽后再关上 | ( )使汽油溶液与水溶液分层 |
| ( )向装有Cl2和NaBr反应产物的分液漏斗中加入适量汽油 | ( )得到溴的汽油溶液,从水溶液中分离出溴 |
| ( )让分液漏斗下端紧靠烧杯内壁 | ( )使溴充分溶解在汽油中 |
| ( )从分液漏斗上口倾倒出液体 | ( )防止分液时液体溅出 |
| ( )把分液漏斗上口的活塞打开 | ( )用汽油作为溴的萃取剂 |
22.A.B.C.D四种分子均含有18个电子
(1) A分子中只有一个原子,则A为:_____
(2) B分子中含有8个原子,则B完全燃烧的化学反应式为:________
(3) C分子可与H2O发生置换反应,若生成1mol单质,则转移电子数为:______.
(4) D的水溶液为弱酸,其铵盐(酸式盐)与NaOH溶液反应的离子方程式为:
_______________________________
23.恒温,恒压下,在一个可变容积的容器中发生如下反应:A(气)+B(气) ![]() C(气)`
C(气)`
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a molC,这时A的物质的量为: _____mol。
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成的C的物质的量为:____ mol
(3)若开始时放入x mol A,2 mol B和1 mol C,到达平衡后,A和C的物质的量分别y mol和3a mol,则x=____ mol,y=____ mol。
平衡时,B的物质的量: ____ (选编号)
(甲) 大于2 mol (乙)等于2 mol
(丙) 小于2 mol (丁)可能大于,等于或小于2 mol
做出此判断的理由是:
(4) 若在(3)的平衡混合物中再加入3 mol C,待再次到达平衡后,C的物质的量分数是:
24.一卤代烷(RX)与金属镁在室温下于干燥乙醚中作用,生成有机镁化物一卤化烷基镁。
![]()
这种产物叫做“Gnignand Reagenl”(格林试剂)。格林试剂很活泼,能与多种具有活性氢的化合物(HY)作用,生成相应的烃。
RMgX+HY→RH+![]()
Y=-OH,-OR,-X(卤原子),-NH2,-NHR,-C≡CR等。格林试剂是有机合成中用途甚广的一种试剂,可以用来合成烷烃、烯烃、醇、醛、酮、羧酸等一系列化合物。
1、可增长碳链的反应:
| | ||||
| ||||
RX+Mg![]() RMgX
RMgX ![]()
2、引入-OH的反应:
例如它跟醛加成后,再在酸性条件下水解可制得醇:
![]()
![]()
当甲醛、乙醛、丙酮与格林试剂、H2O作用后可分别制得伯醇、仲醇、叔醇,这在有机合成工业中有重要意义。
现用乙烯作为唯一的有机原料,选用溴化氢、水、氧气、镁和有关的催化剂制取2—丁醇,写出有关的化学方程式和指定的几个反应的类型
① 属 反应;
② 属 反应;
③ ;
④ ;
⑤ ;
⑥ 。
3、引入—COOH反应:RMgX![]() 试根据上述物质的转化关系,完成下列变化,并按要求回答问题:
试根据上述物质的转化关系,完成下列变化,并按要求回答问题:
(CH3)3COH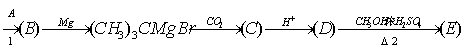
(1)写出B、C、D、E的结构简式:B 、C 、D 、E 。
(2)写出①、②两步反应的化学方程式:
①
②
(3) 使用不超过4个碳原子的开链化合物合成
![]()
![]() CH3—CH—CH2—CH—COOH
CH3—CH—CH2—CH—COOH
CH3 CH3
(4)写出由烃和环已酮为主要原料合成1—甲基环已烯的各步方程式。
25、已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。
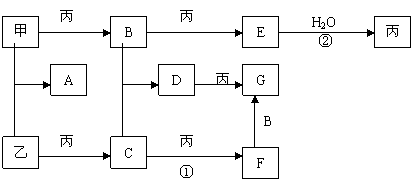 |
试回答:
(1)B的化学式是:______ ,D的名称是_________ ;
(2)用电子式表示A的形成过程:
(3)写出①、②两步变化的化学方程式:
26.X.Y.Z是短周期元素的三种常见氧化物,X跟水反应可生成一种具有还原性的不稳定的二元酸,该酸的化学式是:_____ ;Y和X的组成元素相同,Y的化学式是:_______;1molZ在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,Z的化学式是:______ 在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应化学方程式是: ____________
27.向银氨溶液(含Ag(NH3)2+离子)中加入氯化钠溶液,无白色沉淀生成,说明溶液中无Ag+存在或存在很少,原因是__________________。但加入盐酸后立即产生白色沉淀,可能的原因是________________________________________________________________。
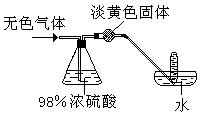 28、有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
28、有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
原气体中一定有 、一定没有 。
29.标况下2.24L无色可燃气体在足量氧气中完全燃烧,产物只有二氧化碳气体和水蒸气,若将产物通入足量澄清石灰水中,得到白色沉淀20g,若用足量的碱石灰吸收燃烧产物,增重12.4g。
(1)求燃烧产物中水的质量;
(2)若原气体是两种等物质的量的气体混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
30.在标准状况下,有含臭氧(O3)的氧气500ml,当其中的O3完全分解后体积可变为528ml。在标准状况下1000ml该混合气体通入足量的KI溶液,求生成碘的质量。(2KI+O3+H2O=2KOH+I2+O2,O2与KI的反应可以忽略。)
2004年澧县一中高三化学总复习试题 (3)
参 考 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | B | C | D | C | B | C | D | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | D | B | C | D | A | C | B | B |
19,答(1)m:n=56:64(2)①无铁粉剩余m:n﹥56:64②有铁粉剩余无法确定(3)略
20答(1)I-和Fe2+ 2mol I-和2mol Fe2+(2)I-、Fe2+和Br- I2 1mol Fe3+ 3mol Br2 0.5mol(3)≥3/2(a+b)mol
21 A 组 3 2 6 1 4 7 5 B 组 6 5 3 7 2 4 1
22(1)Ar (2)2C2H6+7O2=4CO2+6H2O (3)4mol e-
(4)NH4++HS-+2OH-=NH3+2H2O+S2-
23 (1) 1-a (2) 3a
(3) 2 3-3a 丁 B的物质的量应为3-3amol,当1>a>1/3时,B的物质的量小于2mol,当a=1/3时,n(B)=2mol,当a<1/3时,n(B)>2mol
(4) 6amol/(6-3a)×100%=a/(2-a) ×100% 24略
25 (1) Na2O ,D 亚硫酸钠 ;(2)
(3) ① 2SO2+O2=2SO3 ,② 2Na2O2+2H2O=4NaOH+O2;。
26:H2SO3 ; SO3 ; P205 ; 2P+5SO3=5SO2+P2O5
27. Ag(NH3)2+较稳定,难电离 NH3和H+的结合能力强于NH3和Ag+的结合能力。
28、NH3、CO2、NO;O2、HCl、NO2、H2、N2
29 (1)Ca(OH)2+CO2= CaCO3+H2O ∴m(CO2)=20g×44/100=8.8g ∴m(H2O)=12.4g-8.8g=3.6g
(2)∵n(气):n(CO2):n(H2O)=2.24/22.4 : 8.8/44 : 3.6/18=1:2:4 ∴平均分子组成可以表示为C2H4Ox 则符合题意的组成有①CH2O和C3H6 ②CO和C3H8 ③H2和C4H6
30设:500mL混合气体中O3的体积为x,生成碘的质量为y。
2O3=3O2 △V
2ml 3ml 1ml
x (528-500)ml
x=56ml
则1000ml混合气体中含有112mlO3
2KI+O3+H2O=2KOH+I2+O2
22400ml 254g
112ml y
y=1.27g 答:生成1.27g碘。