高三化学示范卷1
第I卷(选择题,共76分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A .氧化牲 B.还原性 C. 碱性 D. 酸性
2.20世纪20年代起,就有人预言可能存在由4个氧原子组成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到它的存在。你认为这种氧分子是:( )
A.氧气的一种同素异形体 B.它的摩尔质量为64
C.一种新的氧化物 D. 一种新的化合物
3.下列各组变化,前者属于物理变化,后者属于化学变化的是 ( )
①水结冰;石墨转化为金刚石 ②胶体的电泳;胶体的聚沉
③蛋白质的变性;蛋白质的盐析 ④金属导电;电解质溶液导电
. DA.①④ B.②③④ C.①② D.①③
4.下列各组物理量中,都不随取水量的变化而变化的是( )
A.水的沸点;蒸发水所需热量
B.水的密度;水中通入足量CO2后溶液的pH
C.水的体积;电解水所消耗的电量
D.水的物质的量;水的摩尔质量
5. 下列叙述中,不正确的是( )
①原子晶体中只含有极性键 ②金属在常温时都以晶体形式存在
③每个水分子内含有两个氢键 ④分子晶体中一定有分子间作用力,有的还可能有氢键
A.①③④ B.②③ C.①②④ D.①②③
6. 下列说法均摘自某科普杂志,你认为无科学性错误的是( )
A.铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
B.一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒
C.“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用
D.用加酶洗衣粉洗涤衣服时,热水比温水好
7.NA代表阿伏加德罗常数,以下说法正确的是( )
A.氯化氢气体的摩尔质量等于NA氯气分子和NA个氢分子的质量之和
B.常温常压下1mol NO2气体与水反应生成NA个NO3—离子
C.121g CCl2F2所含的氯原子数为2NA
D.62g Na2O溶于水后所得溶液中含有O2—离子数为NA
8.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是( )
A.+4 B. +5 C.+6 D. +7
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.硝酸铜是制备Cu-Zn-AI系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用
①Cu与稀硝酸反应制取,3Cu+8HN03=3Cu(NO)3 +2NO↑+4H20
②Cu与浓硝酸反应制取,Cu+4HN03=Cu(NO3)2+2N02↑+2H20
③通氧气于铜屑与稀硝酸的体系中制取,2Cu+4HN03+02=2Cu(N03)2+2H2O
下列说法不正确的是 ( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>②>①
D.三种方案的反应都可以在铁制容器中进行
10.在pH=2中离子可能大量共存,且为透明澄清溶液的离子组是 ( )
A、![]() B、
B、![]()
C、![]() D、
D、![]()
11.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是 ( )
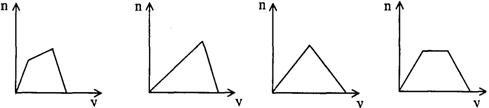
A B C D
12.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是:(说明:在实验过程中不允许加热、过滤、萃取等操作)( )
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | 稀氨水 | Al3+ | Ag+ |
13. NaH是一种离子化合物,它跟水反应的化学方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生H2。下列关于NaH的叙述错误的是( )
A. 跟水反应时水作氧化剂 B. NaH中H-半径比Li+半径小
C. 跟液氨反应时,有NaNH2生成 D. 跟乙醇反应时,NaH被氧化
14.下列离子方程式中,正确的是 ( )
A.过量氯气通入溴化亚铁溶液中3Cl2+ 2Fe2+ + 4Br— = 6Cl— + 2Fe3+ + 2Br2
B.硫氢化钠的水解:HS-+H2O![]() H3O++S2-
H3O++S2-
C.过量二氧化碳通入偏铝酸钠溶液中CO2 + 2H2O +AlO2-= Al(OH)3↓ + CO32—
D.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合
HSO3— +OH— = SO32— + H2O
15.某混合溶液由两种或三种物质溶于水制成,且在溶液中,c(K+)=c(Cl-),c(Na+)=2c(![]() )。则溶质可能是
)。则溶质可能是
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4 D.KCl、K2SO4、Na2SO4
16.下列画有横线的物质在反应中不能完全消耗的有 ( )
A.将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,不断用电火花引燃
B.标准状况下,盛有2.24LNO2与0.51L O2的容器倒扣在水中
C.标准状况下,将11.2L H2S与22.4L O2混合点燃
D.在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
17.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是 ( )
A.稀盐酸,Na2CO3溶液 B.稀H2SO4溶液,NaAlO2溶液
C.Cu,FeCl3溶液 D.浓氨水,AgNO3溶液
18.工业制硫酸时,进入接触室的气体组成为:SO2占7%,O2占11%,N2占82%。据测定,一定体积的混和气体进入接触室后,体积变化为原来的97.2%,则SO2转化率是: ( )
A.50% B.60% C.75.3% D.80%
19.有m1 g KCl饱和溶液,其溶质的质量分数为c1%。改变温度或蒸发水后析出m3g KCl晶体,母液质量为m2g,其溶质的质量分为c2%。则下列关系一定正确的是 ( )
A.c1一定大于c2 B.m1-m3=m2
C.m1c1-m2c2=100m3 D.原条件下KCl的溶解度小于c1g
第II卷(非选择题,共74分)
三、(本题包括2小题,共21分)
20.(9分)参看表格内容,回答下列问题:
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
⑴X、Y、Z、F分别是(写名称) 、 、 、 。
⑵G中的化学键 (填“有”或“没有”)极性。G在固态时属于 晶体
⑶Y和Z直接作用后的生成物属于 晶体。写出它的电子式 .
21.(12分)工业上测定SO2、N2、O2混合气体中SO2含量的装置如下图。反应管中装有碘的淀粉溶液,SO2和I2发生反应为(N2、O2不与I2反应):SO2+I2+2H2O==H2SO4+2HI
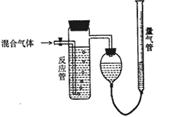 (1)混合气体进入反应管后,量气管内增加的水的体积
(1)混合气体进入反应管后,量气管内增加的水的体积
等于 的体积(填写混合气体的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则
测得的SO2含量 (选填:偏高,偏低,不受影响)
(3)反应管内的碘的淀粉溶液也可以用 代替
(填物质的名称)
(4)若碘溶液体积为Va mL,浓度为Cmol/L。N2与O2的
体积为Vb mL(已折算成标准状况下的体积)。用C、Va、
Vb表示SO2的体积百分含量为 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为 。(填写下列仪器似的编号)
a烧杯 b试管 c广口瓶 d容量瓶 e量筒 f单孔塞 g双空塞
四、(本题包括2小题,共14分)
22.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
⑴请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
⑵已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。则总方程式为___________________________________________________________。
23.(8分)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式:XY2(l)+ 3O2(g)== XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积为 672mL,密度是2.56 g•L-1,则:
①反应前的O2的体积是(标况) ;
②化合物XY2的式量是 ;
③若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 和 。
五、(本题包括2小题,共20分)
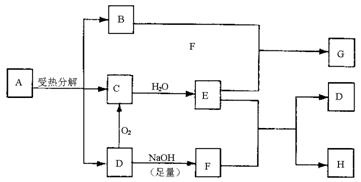
|
回答下列问题:
(1)写出G和H的化学式:G 、H 。
(2)工业生产中D转化为C的反应条件是: 。
(3)B跟E反应的离子方程式是 。
25.(12分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g)+Cl-(g) NaCl(s); △H B.Na(s)+![]() Cl2(g)
Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g);
△H3
E.![]() Cl2(g)
Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式 。
氧化亚铁晶体结构氯化钠晶体结构相似,则:
(3)氯化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为![]() ,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
,则氧化亚铁晶体中二价离子与氧离子之间最近距离是
cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
六、(本题包括2小题,共19分)
26.(9分)在10℃时,向100g25.2%的稀硝酸中先后加入固体NaHCO3和NaOH共20.4g,恰好完全反应,把所得溶液蒸发掉39.5g水后,刚好成为饱和溶液(10℃),求此溶液中溶质的质量和该溶质在10℃时的溶解度。
27.(10分)某化工厂每小时生产98%(质量分数)硫酸at(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为 m3。
(2)为满足题设需求,b%的下限等于 。
参考答案:
一、
1、C 2、A 3、A 4、B 5、D 6、B 7、C 8、B
二、
9、 CD 10、AB 11、D 12、D 13、B 14、AD 15、A 16、C 17、C 18、D 19、C
三、(21)
20 (电子式2分,其余各一分)
(1)碳 硫 钠 过氧化钠
(2)有 分子晶体
(3)离子
21、(第四空4分,其余各2分)(1)N2、O2的体积 (2)偏低 (3)酸性高锰酸钾或溴水
(4)V(SO2)=22.4CVa/(22.4CVa+Vb)
(5) bceg 或 beg 或 ceg
四、(14)
22、(各两分)(1)2NO2—2e-+H2O=4H++2NO3—
2NO2+2e-+2H+=NO+H2O
(2)CH4+2O2+2OH—=CO32—+3H2O
23、(各两分)(1)672ml (2)76 (3)C S
五、(20)
24、(8分)(1)Fe2(SO4)3、Na2SO4(4分,各2分) (2)催化剂、适宜温度(2分,各1分)
(3)Fe2O3+6H+=3H2O(2分)
25、(12分)(1)A或△H(2分) (2)△H1=△H+△H2+△H4+△H5(2分) (3)6个(2分)
(4)![]() (4分) (5)不变(2分)
(4分) (5)不变(2分)
六、(19)
26、 答: 溶质的质量 34g 溶解度 80g
27、答:(1) ![]() (2)7%
(2)7%