高三化学试测题
第Ⅰ卷
一、选择题(本题包括6小题,每小题4分,共24分,每小题只有一个选项符合题意)
1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是
A.NO B.O3 C.CO D.氯氟烃
2.以石墨作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极析出铜的质量是
A.8g B.16g C.32g D.64g
3.室温下0.1mol·L-1NaOH溶液滴定amL某浓度的HCl溶液,达到终点时消耗NaOH溶液bmL,此时溶液中氢离子的浓度[H+]/mol·L-1是
A.![]() B.
B.![]() C.1×107 D.1×10-7
C.1×107 D.1×10-7
4.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e=2Br- ②2Br-—2e=Br2
③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电式的阳极反应和放电时的负极反应的分别是
A.②和③ B.②和① C.③和① D.④和①
5.分子式与苯丙氨酸(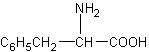 )相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
)相同,且同时符合下列两个条件:①有带两个取代基的苯环 ②有一个硝基直接连接在苯环上的异构体的数目是
A.3 B.5 C.6 D.10
6.将氨水逐滴加入到稀盐酸中,使溶液成中性,则此时
A.[NH4+]=[Cl-] B.[NH4+]>[Cl-]
C.[NH4+]<[Cl-] D.[NH4+]与[Cl-]之间关系不确定
二、选择题(本题包括6小题,每小题4分,共24分,每小题有一个或两个选项符合题意。)
7.在锌片和盐酸的反应中,加入下列试剂,可是生成氢气的速率变慢的是
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
8.某溶液中含三种离子,加入过量氨水有沉淀,过滤后滤液中加入过量盐酸,又有沉淀声称,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀声称,原溶液中含有的离子可能是
A.Ag+、Fe2+、Ca2+ B.Al3+、Mg2+、Ba2+
C.Ca2+、Fe2+、Ba2+ D.Ag+、Mg2+、Ba2+
9.在一杯透明的液体中加入一小颗固体,整杯液体完全转变成固体,则原液体和析出的固体分别可能是
A.过饱和溶液,不带结晶水的晶体 B.饱和溶液,带结晶水的晶体
C.过饱和溶液,带结晶水的晶体 D.-10℃的过冷水,冰
10.A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是
A.A和M原子的电子总数之和可能为11 B.A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
11.下列说法正确的是
A.电解NaOH溶液时,溶液浓度将减小,pH增大
B.电解H2SO4溶液时,溶液浓度将增大,pH减小
C.电解Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解NaCl溶液时,溶液浓度将减小,pH不变
![]() 12.苯并[a]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并和如图。每个碳原子上都一个双键(C=C),分子中共有m个双键,五个环都处于同一平面上,分子中可能同时处于一个平面上的原子数为n个,则m、n分别等于
12.苯并[a]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并和如图。每个碳原子上都一个双键(C=C),分子中共有m个双键,五个环都处于同一平面上,分子中可能同时处于一个平面上的原子数为n个,则m、n分别等于
A.10、30 B.10、32 C.11、30 D.11、32
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
第Ⅱ卷 (共76分)
三、(本大题共2小题,共19分)
13.(6分)把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是 ,该操作的名称是 。
14.(13分)1,2,3,4—四氢化萘的结构简式是![]() ,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2![]() C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1)下面示意图中的装置,适合步骤①和②操作的是 。
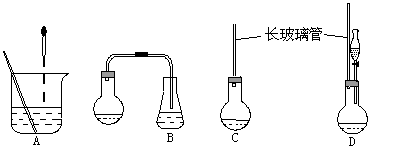
(2)步骤②中如何判断“反应完全” 。
(3)步骤③中补充少量四氢化萘的目的是 。
(4)步骤③中过滤后得到的固体物质是 。
(5)已知在实验条件下,饱和氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反应进行完成,则步骤①中四氢化萘和水的质量比约是1︰ (保留小数点后1位)。
四、(本大题共3小题,共22分)
15.(6分)若以X、Y和Z代表三种元素,且知X与Y可形成原子数之比为1︰1的化合物甲,Y与Z也可形成原子数之比为1︰1的化合物乙,又知甲分子含18个电子,乙分子含38个电子,请填空:
(1)元素Y在第 周期。
(2)化合物甲的分子式是 。
(3)化合物乙的分子式是 。
16.(5分)请写出10个分子式,使每个分子中都含有18个电子。
、 、 、 、 、
、 、 、 、 、
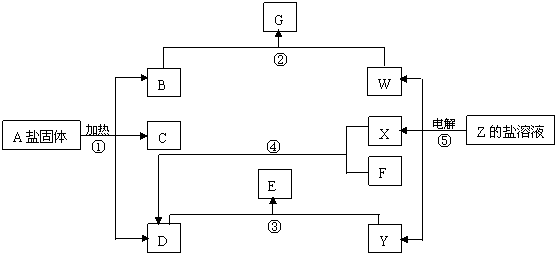
17.(11分)
在一定条件下(不许添加别的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③、④、⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成分之一,其余为化合物,据此请填空:
(1)物质A是 ,F是 ,X是 ,Y是 。
(2)写出反应②的化学方程式 。
(3)写出反应④的化学方程式 。
五、(本大题共2小题,共16分)
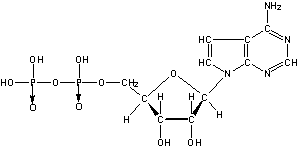
18.(6分)ATP(三磷酸腺苷)的结构如下:
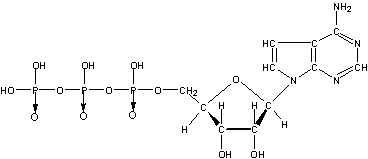
(式中“→”表示配位键,粗线表示这个环上的这些键在纸平面的前面。)
又知ATP+H2O![]() ADP+Pi(磷酸)+能量
ADP+Pi(磷酸)+能量
请写出:
(1)ATP的分子简式是 ,它的摩尔质量是 。
(2)ADP的结构式是 。
19.(10分)有三个只含C、H、O的有机化合物A1、A2、A3,它们互为同分异构体。室温时A1为气态,A2、A3是液态。分子中C与H的质量分数是73.3%。在催化剂(Cu、Ag等)存在下,A1不起反应。A2、A3分别氧化得到B2、B3。B2可以被硝酸银的氨水溶液氧化得到C2,而B3则不能。
上述关系也可以表示如下图:
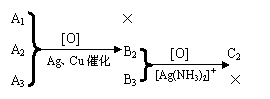 |
请用计算、推理,填写下列空白:
(1)A2的结构简式 ;
(2)B3的结构简式 ;
(3)A3 和C2的反应产物 。
六、(本大题共2小题,共19分)
20.(9分)某有机化合物爆炸后的气体中,各组份的体积分数如下:CO241.38%,H2O(气)34.48%,N220.69%,O23.45%。设爆炸时,并没有掺入空气,试推算该化合物的:
(1)最简式 。
(2)分子式 。
(3)结构式 。
21.(10分)某化工厂每小时生产98%(质量分数)硫酸at(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为 m3。
(2)为满足题设需求,b%的下限等于 。
化学试测题答案
1.B 2.B 3.D 4.A 5.C 6.A 7.BD 8.AD 9.C 10.A 11.BC 12.B
13.(6分)(1)用可见光照射胶体,观察有无“丁达尔现象”,有就是胶体
(2)麦芽糖 渗析
14.(13分)(1)D (2)加入的液溴颜色基本不褪(3)出去过量的溴(4)四溴化萘、铁粉(5)1.3
15.(6分)(1)第二周期(2)H2O2(3)Na2O2
16.(5分)
(1)Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6、CH3OH、CH3NH2……
只回答出其中的10种即可,其它合理答案都可以。
17.(11分)(1)A是(NH4)2CO3(或NH4HCO3),F是N2,X是H2,Y是Cl2。
(2)CO2+2NaOH=Na2CO3+H2O(或CO2+NaOH=NaHCO3)
 |
(3)N2+3H2![]() 2NH3
2NH3
18.(6分)(1)A—P~P~P;507
(2)
19.(10分)(1)CH3CH2CH2OH(2)![]()
(3)CH3CH2COOCH(CH3)2
20. (9分)(1)C3H5N3O9(2)C3H5N3O9(3)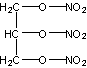
21.(10分)(1)![]() (2)7%
(2)7%