高三化学试卷
注意:本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间90分钟。
第I卷(选择题 共74分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Na 23 Ba 137
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1、2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A、单质钠的密度比钾的密度小
B、钠和钾在空气中燃烧的产物都是过氧化物
C、钠和钾都是短周期元素
D、钠和钾的合金[ω(K) = 50%—80% ]在室温下呈液态
2、三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价或再生的水电,相当于每年5000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制: ①氮氧化物的排放 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤白色污染
A、①②④ B、 ②④ C、 ③④ D、①②⑤
3、人们把食品分为“绿色食品”、“蓝色食品”、“白色食品”等,绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”。下列物质属于“白色食品”的是
A、面粉 B、食醋 C、海带 D、菜油
4、下列除去杂质的方法正确的是
A、除去N2中的少量的CO:通过足量的灼热的CuO粉末,收集气体
B、除去SO2中的少量的C2H4:通过足量的溴水,收集气体
C、除去AlCl3溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
 D、除去MgCl2溶液中少量的FeCl3:加足量MgO,过滤
D、除去MgCl2溶液中少量的FeCl3:加足量MgO,过滤
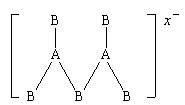
5、由ⅢA族元素A和ⅥA族元素B组成的阴离子有如
右图所示结构,从其结构分析,该阴离子所带的电
荷数x为
A、1 B、2
C、3 D、4
6、希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:
4Fe3++2H2O === 4Fe2++4H++O2↑,下列有关该实验的说法错误的是
A、反应后溶液的pH降低 B、每生成1 mol O2转移4 mol电子
C、叶绿体被氧化 D、该实验可说明光合作用产生的氧气来源于水
7、将1×10 -3 mol·L-1 的盐酸a L跟下列3种溶液混合后,溶液均成中性。
①1×10 -3mol·L-1 的氨水b L;②c (OH - ) = 1×10 -3 mol·L-1 的氨水c L;③c (OH - ) = 1×10 -3 mol·L-1 的Ba(OH)2 d L。其中a、b、c、d的关系正确的是
A、a=b>c>d B、b>a=d>c C、b>a>d>c D、c>a=d>b
8、近年来科学家发现有100个碳原子构成一个具有完美对称性的C100 原子团,其中每个碳原子仍可形成4个化学键。最内层是由20个碳原子构成的正十二面体(即每个碳与其它三个碳相连)。外层的60个碳原子形成12个分立的正五边形(即每个碳原子与其它2个碳相连)。处于中间层次的碳原子连接内外层碳原子。当它与氢或氟形成分子时,其分子式为
A、C100H20和C100F20 B、C100H60和C100F60
C、C100H12和C100F12 D、C100H40和C100F40
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合项意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
 9、两种有机物以一定比例混合,一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中可能符合此条件的是
9、两种有机物以一定比例混合,一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是aL,下列混合有机物中可能符合此条件的是
A、CH4 C2H4 B、CH3OH CH3COOH
C、C2H6 HCHO D、HCOOH,CH3COOCH3
10、金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,
如右图所示。金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷
(C10H14ClBr)的同分异构体数目是
A、4种 B、6种 C、8种 D、10种
11、往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解和离子的水解都忽略不计)
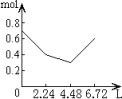
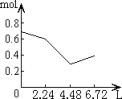
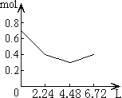
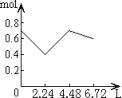
A B C D
12、铝和镓的性质相似,如M(OH) 3 都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3 中。用NaOH 溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3 沉淀,而NaGaO2 留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A、镓酸酸性强于铝酸 B、铝酸酸性强于镓酸
C、镓浓度小,所以不沉淀 D、Al(OH)3 是难溶物
13、下列离子方程式或化学方程式正确的是
A、SO2气体缓慢地通人Na2O2固体粉末中:2Na2O2+2SO2=2Na2SO3+O2
B、常温时偏铝酸钠溶液pH>7:AlO2-+2H2O=Al(OH)3↓+OH-
C、Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D、将少量氢氧化钡溶液滴人过量的硫酸氢钠溶液中 H++SO42-+Ba2++OH-=BaSO4↓+H2O
14、按反应物与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种类型,下列反应中属于加成反应的是( )
A、C6H5CH2Cl + NaCN → C6H5CH2CN + NaCl
B、C6H5Li + CO2 → C6H5COOLi
C、CH3CH2CHO + HCN → CH3CH2CH(CN)OH
D、CH3COOH +C2H5OH → CH3COO C2H5 + H2O
15、高氯酸是最强的酸,质量分数为60%的高氯酸溶液加热不分解,浓度增高就不稳定,受热易分解,热、浓的高氯酸溶液遇有机物易爆炸,纯高氯酸的沸点是130℃。现有市售的70%高氯酸,为使其进一步浓缩,所采取的措施正确的是
A、 加入浓硫酸后再小心常压蒸馏
B、 各仪器连接处的橡皮塞应塞紧防止漏气
C、 加入浓硫酸后再减压蒸馏
D、各仪器连接处必须用磨口玻璃装置
16、电视剧《西游记》中仙境美仑美奂。这些神话仙境中所需的烟幕是用NH4NO3 和Zn粉按质量比8∶6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成。有关的说法中正确的是
A、水起着溶解NH4NO3,发生吸热现象以启动反应的作用
B、每还原1mol NO3- 需氧化1mol Zn和1mol NH4+
C、成烟物质是锌的氧化物小颗粒
D、成烟物质是小锌粒,它由NH4NO3反应放热而蒸出
17、某溶液含有大量Ag+、NH4+、Al3+、Fe2+四种离子。往该溶液中加入足量Na2O2,充分搅拌后,再加人过量稀盐酸,此时溶液中一定能大量存在的离子是
A、Na+、NH4+、OH- B、Fe2+、Al3+、Cl-
C、Na+、Fe3+、Al3+ D、Ag+、Fe3+、NH4+
18、生物体中细胞膜内的葡萄糖与细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关电极反应及产物的判断正确的是
A、负极发生的电极反应可能是6O2+24e-+12H2O====24OH-
B、正极发生的电极反应可能是C6H12O6 —24e-+24OH-====6CO2+18H2O
C、负极反应的产物主要是C6H12O6 被氧化生成的CO32— 、HCO3— 、H2O
D、正极反应的产物主要是葡萄糖生成的CO2、CO32— 和H2O
第Ⅱ卷 非选择题(共76分)
三、(本题共18分)
19、高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;
第二: 。
Na2O2跟水反应的化学方程式是 ,
(2)某研究性学习小组拟用A图所示装置(气密性良好)
进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
__________________________________用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)试剂: 。
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为 。
(选填“100mL”“200mL”“500mL”或“1000mL”)。
四、(本题包括2小题,共28分)
20、已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度远 大于第二步的电离程度,第二步的电离程度远大于第三步电离程度。……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①HA + HC2—(少量) == A— + H2C—
②H2B(少量) + 2A— == B2— + 2HA
③H2B(少量) + H2C— == HB— + H3C
回答下列问题:
(1)相同条件下,HA、H2B、H3C三种酸中酸性最强的是 。
(2)A—、B2—、C3—、HB—、H2C—、HC2— 六种离子中,最易结合质子的是 ,最难结合质子的是 。
(3)判断下列反应的离子方程式中正确的是(填写标号) 。
A、H3C + 3A— == 3HA + C3— B、HB—+A— == HA+B2— C、H3C+B2— == HB—+H2C—
(4)完成下列反应的离子方程式
A、H3C+OH—(过量): 。
B、HA(过量) + C3— : 。
21、1991年Langmuir提出:“凡原子数与总电子数相等的物质,则结构相同,物理性质相近”,称为等电子原理。相应的物质,互称为等电子体.化学科学家常用“等电子体”来预测不同物质的结构与性质,例如CH4与NH4+ 有相同的电子数目及空间构形.
(1)依据等电子原理在下表空格处填写相应的化学式:
| CH4 | CO32- | C2O42- | N3B3H6 | |||
| NH4+ | N2H62+ | NO2+ | N2 |
(2)(BN) 3 是一种新的无机合成材料,它与某单质互为等电子体.工业上制造(BN) 3的方法之一是用硼砂(Na2B4O7)和尿素在1073~1273K时反应,得到α—(BN)3 及其它元素的氧化物.α-(BN)3可作高温润滑剂、电气材料和耐热的涂层材料等。如在高温高压条件下反应,可制得β—(BN)3,β—(BN)3 硬度特高,是作超高温耐热陶瓷材料、磨料、精密刃具的好材质.
①它与什么单质互为等电子体 ;
②写出硼砂和尿素的反应方程式 ;
③α—(BN)3与 的晶体结构相似,β—(BN)3 与 的晶体结构相似.
五、(本题包括2小题,共18分)
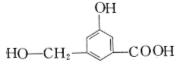
22、A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式为:
![]()
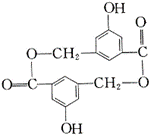 (1) A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3
(1) A既能和NaOH溶液反应,又能和NaHCO3溶液反应,写出A和NaHCO3
溶液反应的化学方程式 。
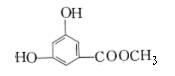
(2) 有机物B在浓H2SO4存在条件下,相互作用生成一种环状酯
(右图),则有机物B的结构简式为 ___________。
等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、
NaHCO3的物质的量之比为 。
(3) D和B互为同异构体,且知苯环上的一氯代物只有两种,
D不与NaHCO3反应,能与Na和NaOH反应,等质量的D
消耗Na和NaOH的物质的量比为2∶3,则D的结构简式为 。(只写一种)
(4) 1 mol A、C完全燃烧,消耗O2的质量相等,且1 mol C能和1 mol Na完全反应,写出含碳原子数最少的C的结构简式 。
23、2001年是20世纪伟大的化学家泡林(Linus Pauling 1901—1994)
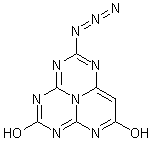 诞辰100周年纪念。他是一位化学结构大师,因对化学键的本性及其对
诞辰100周年纪念。他是一位化学结构大师,因对化学键的本性及其对
复杂物质结构的解释而获得1954年度的诺贝尔化学奖。1994年这位世纪
老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,
其中有一结构式如图所示。老人为什么画这个结构式?它在自然界存在
吗?它是炸药吗?它能合成吗?它有什么性质?……不得而知。这是泡
林留给世人的一个迷。也许这是永远无法解开的迷,也许你有朝一日能
解开它。
请你对这个结构作一番分析后,回答下列问题。
(1)它的分子式是 。
(2)如果该分子中的氮原子都在一个平面上,那么该分子中的所有原子是否可能处于同一平面内 (填“可能”或“不可能”)。
(3)该分子的侧链相当于叠氮酸根,它类似于一种叫叠氮酸铅的雷管起爆剂,因此有人预测它是炸药,如果它在没有氧气参与的情况下爆炸,反应的化学方程式(发生分解反应,生成两种单质和两种化合物)是 ;如果在有足量氧气参与的条件下发生爆炸,那么,1 mol该化合物爆炸时需消耗 mol氧气。
六、(本题共17分)
![]() 24、一定条件下,某容积为1L的密闭容器中发生如下反应:
24、一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s) + H2O(g) CO(g) + H2(g)
(Ⅰ)⑴维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为 。
⑵ 在⑴中若充入的是2.5 mol CO(g) 和4 mol H 2 (g) ,达到平衡后混合气体的平均分子量为 ;若要求达到平衡后混合气体的平均分子量始终大于该值,则充入的CO、H2 混 合气体的总质量m和总物质的量n必须满足的关系为 __________________________
![]() (Ⅱ)维持温度不变,若在⑴中同时充入1 mol Br2(g),发生如下反应:
(Ⅱ)维持温度不变,若在⑴中同时充入1 mol Br2(g),发生如下反应:
H2(g) + Br2(g) 2HBr(g)(忽略其他反应)。
⑶当上述体系达到平衡后,测得容器中c (H2O)平 = 0.4 mol/L,c (Br2)平 = 0.6 mol/L,则平衡时c (H2)平 = mol/L。
⑷若平衡时测得混合气体的密度是相同条件下H2的26倍,则c (CO)平 = mol/L,若此时c (Br2)平 = 0.8 mol/L,则c (H2)平 = mol/L。
⑸当上述体系达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不可能同时是:
和 ,或 和 (填化学式)。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 选项 | D | B | B | D | D | C | B | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 选项 | BD | C | A | A | C | BC | CD | BC | C | C |
19:(1)该反应是放热反应(1分);
2Na2O2+2H2O === 4NaOH+O2↑(2分);Na2O2(1分);Na2O2(1分)
(2)将带火星的木条靠近导管口P处,木条复燃(3分);将导管q浸入水中,反应过程中导管口有气泡冒出(3分)
(3)MnO2(2分);气泡迅速产生,能使带火星的木条复燃(1分)(或Na2S溶液;溶液变浑浊。只要合理均可给分)
(4)①Ⅱ(1分) 防止气体冷却时发生倒吸现象(2分) ②500mL(3分)
2O:(1)H2B (2)C3-;HB-; (3)B、C
(4)A:H3C+3OH-=C3-+3H2O B:2HA+C3-=2A-+H2C-
21:C2H6 NO3- CO2 N2O4 C22- C6H6
![]() (2) ①碳②3Na2B4O7+6CO(NH2)2 4(BN)3+6NaHCO3+9H2O
.③金刚石,石墨
(2) ①碳②3Na2B4O7+6CO(NH2)2 4(BN)3+6NaHCO3+9H2O
.③金刚石,石墨
22:(1)
(2) 3:2:1
3:2:1
(3)
(4)![]()
23:(1) C7H2N9O2 (2)可能
(3) 2C7H2N9O2 = 2H2O+2CO+9N2+12C 6
24:(1)15<M<18 (2)12;m>12n (3)1.2 (4)1.0,0.8
(5)H2O和CO或Br2和HBr