高三化学适应性练习
张英锋
河北省秦皇岛市第一中学
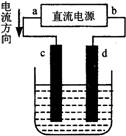 1.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
1.右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中、d电极质量增加 D.电解过程中,氯离子浓度不变
2.已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A.C8H18(l)+22.5O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) ΔH=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) ΔH=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1) ΔH=-48.40kJ·mol-1
3.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
4.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
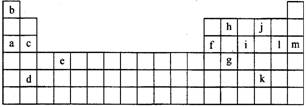 5.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
5.下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k
③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(KJ·mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。(①Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难。)
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
6.合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应1m3(标准状况)CH4按上述两式完全反应,产物气体的体积(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
|
该反应的平衡常数可表示为:K=C(K)
各物质的沸点与压强的关系见右表。
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是 。
(3)常压下,当反应温度升高至900℃时,该反应的平衡常数可表示为: 。
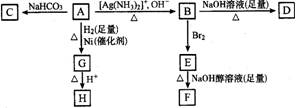 8.根据图示填空
8.根据图示填空
(1)化合物A含有的官能团是 。
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时发生两种发生,其反应类型分别是 。
(3)D的结构简式是 。
(4)1molA与2molH2反应生成1molE,其反应方程式是 。
(5)与A具有相同官能团的A的同分异构体的结构简式是: 。
9.A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分数分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称: 。
(2)若以MA、MB、MC分别表示A、B、C的相对分子质量,试写出MA、MB、MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次为 ,mB:mC= 。(保留2位小数)
10.I.恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入xmolA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2mol (乙)等于2mol (丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
参考答案:
1.C 2.B 3.B 4.B
5(1)①④
(2)②a Na2O和Na2O2 ③ⅢA或第三主 ④m
6.(1)133.9
(2)3m3<V<4m3
(3)设H2O为Xmol,O2为Ymol
则![]()
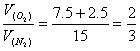
(4)设富氧空气中O2的体积分数为a,反应用去的H2O(g)与富氧空气的体积分别为X、Y。
![]() (用其它方法解得也给分)
(用其它方法解得也给分)
7.(1)770℃ 890℃
(2)降低压强或移去钾蒸气,适当升高温度
(3)![]()
8.(1)碳碳双键,醛基,羧基
(2)消去反应,中和反应
(3)NaOOC-CH=CH-COONa
(4)OHC-CH=CH-COOH+2H2![]() HO-CH2-CH2-CH2-COOH
HO-CH2-CH2-CH2-COOH
![]() (5)
(5)
9.(1)碳酸锂、碳酸铍、碳酸钠、碳酸镁
(2)mA/MA=mB/MB+mC/MC或MC<MA<MB或MB<MA<MC
(3)2 Li2CO3、MgCO3
(4)MgCO3,BeCO3, Na2CO3 1:1:1.05
10.(1)(1-a)
(2)3a
(3)2 3-3a
丁 若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;若3a<1,B的物质的量大于2mol
,B的物质的量等于2mol;若3a<1,B的物质的量大于2mol
(4)![]()
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。