高三化学双基测试题
化 学 试 卷
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共四大题,38小题。满分100分。考试时间90分钟。
可能用的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Cl:35.5
Fe:56 Cu:64
第Ⅰ卷(选择题共72分)
一、选择题(本题包括27小题,每小题只有一个选项符合题意,每小题2分,共2分×27=54分)
1.下列反应中,调节反应物的用量或浓度以后,不会改变反应产物的是 ( )
A.酒精在氧气中燃烧 B.在硫酸中加入铝粉
C.将二氧化碳气体通入烧碱中 D.向盐酸中加入铁钉
2.下列叙述中,不正确的是 ( )
A.原电池负极上发生的反应是氧化反应
B.失电子能力弱的物质获得电子的能力一定强
C.阳离子在氧化还原反应中,可能表现氧化性,也可能表现还原性
D.氯气分子在反应中,作氧化剂的同时也可能是还原剂
3.氨水中和纯碱溶液中的离子种类,前者与后者的关系是 ( )
A.大于 B.小于 C.等于 D.不能确定
4.相同质量的两份醋酸分别与CH3CH218OH和CH3CH216OH在一定条件下反应,生成的酯的质量分别是a和b,则a、b关系正确是 ( )
A.a=b B.a<b C.a>b D.不能确定
5.下列有机物分子能够发生酯化反应的是 ( )
A.油脂 B.石炭酸钠 C.葡萄糖 D.氯仿
6.下列实验事实可以用同一化学反应原理解释的是 ( )
A.乙烯与SO2都能使溴水褪色
B.氢氧化钠和纤维素都能与醋酸反应
C.烧碱和乙酸钠的溶液都能使酚酞试液变红
D.向乙醛和葡萄糖溶液中加入新制氢氧化铜,加热,都有砖红色沉淀产生
7.X、Y、Z三种非金属元素的原子具有相同的电子层数,它们的气态氢化物分别为XH3、H2Y、HZ,下列说法正确的是 ( )
A.原子序数X>Y>Z B.非金属性X<Y<Z
C.原子半径X<Y<Z D.离子还原性X3-<Y2-<Z-
8.铝与氢氧化钠溶液反应,镁与稀硫酸反应,在相同条件下生成的气体体积相同,则消耗铝与镁的物质的量之比为 ( )
A.1:1 B.2:1 C.3:2 D.2:3
9.实验室收集下列气体时,一定要用排气法收集的是 ( )
A.一氧化氮 B.氢气 C.氨气 D.氯气
10.以下方法中能够证明某无色透明液体是纯净水的是 ( )
A.测得该溶液中c(H+)=c(OH-)
B.向其中投入豆粒大小的金属钠,钠浮在液面上迅速游动,发出咝咝响声
C.在一个大气压下,4℃时测得其密度为1g/mL
D.测其导电能力很弱
11.H+物质的量浓度和体积都相等的盐酸、硫酸和醋酸三种溶液分别与足量的小苏打反应,下列有关叙述正确的是 ( )
A.硫酸与小苏打反应最剧烈 B.相同条件下,三者产生的气体体积相同
C.醋酸与小苏打反应放出的气体最多 D.盐酸、醋酸与小苏打反应产生的气体休积相同
12.已知Z1、Z2是两元素的原子序数且Z1>Z2,则元素的相对原子质量前者与后者的比较正确的是 ( )
A.大于 B.小于 C.等于 D.不能确定
13.把1L0.1mol/L醋酸溶液用蒸馏水稀释到10L,下列叙述正确的是 ( )
A.![]() B.
B.![]()
C.![]() 的比值增大 D.溶液的导电性增强
的比值增大 D.溶液的导电性增强
14.常温时,纯水中由水电离的![]() 的盐酸中由水电离的
的盐酸中由水电离的
![]() 苛性钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是 ( )
苛性钠溶液等体积混合后,由水电离出的c(H+)=c,则a、b、c的关系正确的是 ( )
A.a>b>c B.a<b<c C.a>c>b D.a<c<b
15.下列物质不能直接由单质化合得到的是 ( )
A.CuCl2 B.FeCl2 C.FeS D.Na2O2
16.将NH3气体通入到饱和食盐水中,没有沉淀生成,再通入适量CO2有晶体析出,该晶体是 ( )
A.Na2CO3 B.NaHCO3 C.NaCl D.NaOH
17.用即热饭盒盛装食物,可以得到热烘烘的午饭,原因是即热饭盒的底部装入了镁和铁的合金粉末,以及混合了高密度的聚乙烯,当剥去底部的厚硬纸板后,水和镁发生化学反应,放出热量,便可使食物变热,其中铁的作用可能是 ( )
A.是其中一种反应物 B.起催化剂作用
C.起导热作用 D.减少镁与水分子的接触机会
18.下列离子方程式正确的是 ( )
A.在热的烧碱溶液中加入铝箔Al+2OH- AlO2-+H2↑
B.铁与稀硫酸反应:2Fe+6H+ 2Fe3++3H2↑
C.氯气与水反应:Cl2+H2O
2H++Cl-+ClO-
D.向硫酸铝溶液中滴加过量氨水,Al3++3NH3·H2O Al(OH)3↓+3NH4+
19.若常温时,某溶液由水电离出来的c(H+)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.K+、NH4+、Cl-、NO3- B.K+、Na+、Cl-、SO![]()
C.Na+、Fe2+、Cl-、NO3- D.K+、Na+、Cl-、HCO3-
![]() 20.一定条件下,AL密闭容器中加入1molN2和3molH2发生N2+3H2 2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是 ( )
20.一定条件下,AL密闭容器中加入1molN2和3molH2发生N2+3H2 2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是 ( )
A.![]()
B.![]()
![]() C.单位时间内有1个N N键断裂的同时,有6个N—H键断裂
C.单位时间内有1个N N键断裂的同时,有6个N—H键断裂
D.单位时间内有0.3molH2消耗的同时,生成0.2molNH3
21.常温常压下,下列各组混合物放入试管中静置后,能分层的是 ( )
A.甘油和水 B.油脂和水
C.乙酸和水 D.乙醛和水
22.下列各有机物在酸性条件下发生水解反应时,生成两种不同的有机物,且这两种有机物的相对分子质量相等,这种有机物可能是 ( )
A.硬脂酸甘油酯 B.麦芽糖
C.乙酸乙酯 D.蔗糖
23.下列物质中,不属于高分子化合物的是 ( )
A.纤维素 B.肥皂的有效成分
C.蛋白质 D.淀粉
24.物质的量浓度都是0.1mol/L的下列溶液中,其碱性最强的是 ( )
A.醋酸溶液 B.硫酸铝溶液
C.氨水 D.硫酸钠溶液
25.能够证明浓硫酸具有强化性的事实是 ( )
A.浓硫酸可用铝、铁制容器盛装 B.不能用浓硫酸干燥氨气
C.和NaCl反应制HCl D.和Na2SO3反应制SO2
26.bg某金属与足量稀硫酸反应,生成该金属的三价正盐和ag氢气。则该金属的相对原子质量为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
27.互为同分异构体的一组物质是 ( )
A.淀粉和纤维素 B.蔗糖和葡萄糖 C.果糖与麦芽糖 D.正戊烷与异戊烷
二、选择题(本题包括6小题,每小题只有一个选项符合题意,每小题3分,共3分×6=18分)
28.将等质量的铜分别放入下列溶液中,加热、充分反应后,在标准状况下有气体生成且质量最小的是 ( )
A.稀HNO3 B.浓HNO3 C.稀盐酸 D.浓硫酸
29.体积相等的CH3COOH溶液与NaOH溶液反应,若反应后溶液呈中性,则 ( )
A.CH3COOH溶液与NaOH溶液的物质的量浓度相等
B.CH3COOH溶液的物质的量浓度比NaOH溶液的物质的量浓度小
C.CH3COOH溶液的物质的量浓度比NaOH溶液的物质的量浓度大
D.CH3COOH与NaOH的质量相等
30.A、B、C为三种短周期元素,A、B同周期;A、C的最低价离子分别为A2-、C-,其离子半径A2->C-。B2+与C-具有相同的电子层结构,下列叙述一定不正确的是 ( )
A.它们的原子序数:A>B>C B.它们的原子半径:C>A>B
C.离子半径:A2->C->B2+ D.原子最外层电子数:C>A>B
|
|
A. B. CH2—CH—COOH
|
C. D.CH3COOCH2CH3
32.有氧化铜和二氧化二铁的混合物ag,加入2mol/L的HCl溶液50mL,恰好完全溶解,若将2ag该混合物在CO气流中加热并充分反应,冷却后,剩余固体的质量为 ( )
A.(2a-1.6)g B.(2a-3.2)g C.1.6ag D.0.8ag
33.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水后,得到溶液的密度为qg/mL,物质的量浓度为c。则该溶液溶质的相对分子质量可表示为 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
|
三、填空题(本题包括4小题,共23分)
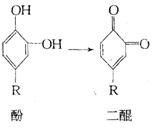
34.(5分)俗话说:“饭后一苹果,疾病远离我。”吃水果能帮助消化,当我们把苹果切开后不久,果肉上便会产生一层咖啡色的物质,好像生了“锈”一般,其原因是果肉里的酚在空气中转变为二醌,这些二醌很快聚合成为咖啡色的聚合物。
①这一变化(酚变为二醌)的反应类型为 (填序号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
②若要避免苹果“生锈”,请你选择一种保存切开的苹果的方法, ,
其原因是 。
35.(6分)实验室制取干燥NH3时,不能用浓H2SO4干燥,
①其原因是 。
②稀释浓硫酸时,应先向烧杯中加入 ,然后再
。
③写出NH3的电子式 ;其结构呈 。
36.(6分)(1)在25℃条件下,将c(H+)=10-3moL的醋酸溶液稀释100倍,稀释后溶液的
c(H+)变为 (填序号),其主要原因是
。
A.10-5mol/L B.10-3mol/L
C.10-5mol/L~10-3mol/L之间 D.在10-3mol/L~10-2mol/L
(2)室温下,若将0.05molHCl气体和0.1molCH3COONa全部溶于水,形成1L混合溶液,请写出溶液中存在有关平衡的离子方程式:
|
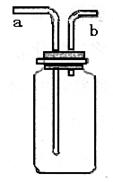
37.(6分)若用右图所示装置收集NO气体,应采取的
主要操作步聚是:
应该先将该装置 ;
然后
。
四、计算题(本题包括1小题,共5分)
38.(5分)用密度为1.19g/cm3、质量分数为36.5%的浓盐酸252mL与足量的二氧化锰反应,生成的氯气在标准状况下的体积为16.8L。计算:
(1)在反应中被氧化的HCl的物质的量。
(2)浓盐酸中HCl的物质的量浓度范围。
高三双基测试题
化学试卷参考答案及评分标准
一、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | B | B | C | C | D | B | D | C | D | C | D | C | C |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | |
| B | B | B | D | B | C | B | D | B | C | C | C | D |
二、
28.A 29.C 30.B 31.B 32.A 33.C
三、
34.(5分)①a(1分)②放入水中(2分),因切开的苹果易被氧化,放入水中,使果肉不与空气接触,减缓氧化速率(2分)
35.(6分)①硫酸与NH3反应生成(NH4)2SO4(2分)
②水(1分),沿玻璃棒慢慢倒入浓硫酸(1分)
H
·×
③H:N:H(1分);三角锥形(1分)
··
36.(6分)C(1分)稀释时,促进醋酸的电离(2分)
![]() (2)CH3COO-+H2O
CH3COOH+OH-(1分)
(2)CH3COO-+H2O
CH3COOH+OH-(1分)
![]() CH3COOH
CH3COO-+H-(1分)
CH3COOH
CH3COO-+H-(1分)
![]() H2O
H++OH-(1分)
H2O
H++OH-(1分)
37.(6分)充满水;NO从b管导入;a管口导出(各2分)
四、 △
38.(5分)解:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑
n(Cl2)=0.75mol
![]()
需浓盐酸的体积252mL……………………………(1分)
所以HCl的物质量浓度应大于11.9mol·L-1………………(1分)
被氧化的HCl的物质的量为1.5mol………………(1分)
(注:其它正确解法参照给分)