高三化学同步测试(1)
本试卷分I卷和Ⅱ卷两部分。第Ⅰ卷为选择题,本卷考试时间:120分钟, 满分:150分。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Ca-40 Na-23
第Ⅰ卷 选择题 (满分72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.下列物质一定不是天然高分子的是 ( )
A. 橡胶 B. 蛋白质 C. 尼龙 D. 纤维素
2.在恒温恒容的容器中进行反应H2![]() 2H;
△H>0,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需2s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为( )
2H;
△H>0,若反应物浓度由 0.1 mol·L-1降到0.06 mol·L-1需2s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为( )
A. 等于18s B.等于 12s C. 大于18s D.小于18s
3. 在医院中,为酸中毒病人输液不应采用 ( )
A. 0.9%氯化钠溶液 B. 0.9%氯化铵溶液
C. 1.25%碳酸氢钠溶液 D. 5%葡萄糖溶液
4.硫酸铵在强热条件下分解:生成NH3、SO2、N2和H2O,该反应中的氧化产物和还原产物的物质的量之比为 ( )
A. l:3 B.2:3 C.4:3 D.l:l
5. 在由水电离出的c(H+)= 1×10-13 mol·L-1的溶液中,可能大量共存的离子组是( )
A. Fe2+, Na+, NO3-, Cl- B. Ba2+,Na+, NO3-,Cl-
C.SO42-,S2O32-,NH4+,Na+ D.Mg2+,Na+,Br-,AlO2-
6. 下列事实与氢键有关的是 ( )
A. 水加热到很高的温度都难以分解
B. 水结成冰体积膨胀,密度变小
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
7. 在容积恒定的密闭容器中放入2molA和1molB在一定条件下发生反应:2A(g)+B(g)![]() 2C(g)当达到平衡时测得压强减小
2C(g)当达到平衡时测得压强减小![]() ,则A的转化率为 ( )
,则A的转化率为 ( )
A. 60% B. 50% C. 40% D. 30%
8. 下列说法不正确的是 ( )
A. C2H4O可能的结构有3种
B. 烃分子中连有甲基,则氢原子不可能都在同一个平面上
C. 组成为CxH4的烃燃烧前后总体积不变
D. 甲苯既可发生加成反应,也可发生取代反应,还可发生氧化反应
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9. A、B短周期元素,二者能形成化合物 AB2已知 A的原子序数为 n,B的原子序数为:
n+2②n+5③n+10④n+13⑤n-3⑥n-6⑦n-8⑧n+1其中 ( )
A. ⑤不可能 B. ④⑥不可能 C. ⑤⑥不可能 D. 都可能
10. 日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收 H2), 电极反应可简化为:Zn-2e-==Zn2+;2NH4++2e- =NH3+H2,根据上述叙述判断下列说法正确的是 ( )
A. 干电池中锌为正极,碳为负极
B. 干电池工作时,电子由锌极经外电路流向碳极
C. 干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D. 干电池可实现化学能向电能的转化和电能向化学能的转化
11 . 下列离子方程式正确的是 ( )
A. 在氯化铝溶液加入过量的偏铝酸钠溶液 A13+ +3AlO2- + 6H2O= 4Al(OH)3↓
B. 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-= BaSO4↓
C. 在澄清石灰水中通入过量二氧化碳 OH-+CO2=HCO3-
D. 在碳酸氢钙溶液中加入过量氢氧化钠溶液 Ca2++ HCO3-+ OH-=CaCO3↓+H2O
12. 25℃时若体积为 Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知 Va<Vb和 a=0.5b,则下列符合 a值的是 ( )
A. 3 B. 4 C. 5 D. 6
13. 在10mL0.01 mol·L-1的纯碱溶液中,不断搅拌并逐滴加入 l.2mL0.05mol·L-1的盐酸,完全反应后在标准状况下生成二氧化碳的体积为 ( )
A. 1.344mL B. 2.240mL C. 0.672mL D. 0mL
14. 氯只有35Cl和37Cl两种稳定同位素,它们在氯气中的原子数之比35Cl:37Cl为 3: l,则分子量为70、72、74的氯气分子数之比不可能是 ( )
A. 5:2:l B. 5:2:2 C. 9:3:l D.9:3:2
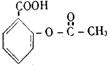
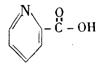 15. 在一定条件下,下列药物的主要成分都能发生①取代反应②加成反应③水解反应④中和反应四种反应的是 ( )
15. 在一定条件下,下列药物的主要成分都能发生①取代反应②加成反应③水解反应④中和反应四种反应的是 ( )
A.维生素 B. 阿斯匹林
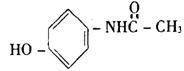
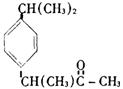
C.芬必得 D. 扑热息痛
16.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
17.下列溶液暴露于空气中,开始一段时间其pH变小的是(不考虑溶质挥发) ( )
①H2S ②H2SO3 ③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3
A. ①③④ B. ②⑤⑥ C. ①②④⑤ D. ②④⑤⑥
18. 在密容器中,aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积扩大1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是 ( )
bB(g)达平衡后,保持温度不变,将容器体积扩大1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是 ( )
A. 平衡向正反应方向移动了 B.物质A的转化率减少了
C. 物质B的质量分数增加了 D.a>b
第Ⅱ卷 非选择题 (满分78分)
三. 本题包括2小题, 共19分
19. (6分)回答下列问题:
(l)实验室采用铜丝和浓H2SO4反应的原理,制取少量二氧化硫气体,通常需要哪些仪器?
(2)将SO2气体通入红棕色的溴水中,可以使溴水褪色。甲同学分析说褪色是由SO2的还原性造成的;乙同学分析说褪色是SO2漂白性造成的。请你根据SO2漂白性的特点设计一个简单的实验,证明甲、乙 两同学到底谁的分析正确?
20. (13分)实验室常用草酸(H2C2O4)和浓硫酸反应(加热)制取CO:
浓硫酸(加热)
H2C2O4 → H2O+CO↑+CO2↑
现进行CO的制取和还原氧化铜,并证明CO的氧化产物及测定铜的相对原子质量的实验,有关装置图如下所示:
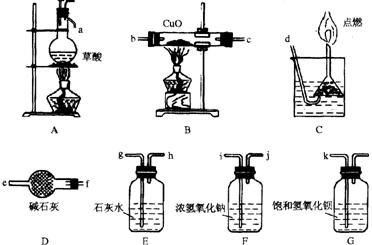
试回答:
(1)若按气流从左到右,每个装置都用到而且只能用一次,则各仪器之间的连接顺序
为(用接口处字母编号表示)_______________________________。
(2)在装置A中,分波漏斗与蒸馏烧瓶之间连接导管的作用是使漏斗中的液体能顺利下滴,其原理是_______________________________________________;C装置导管先通入一倒置在水中的漏斗,然后点燃的原因是______________________。
(3)如果实验效果达到预想要求的话,E装置内的现象应为__________________________;G装置的作用为________________________。
(4)若测知反应物CuO的质量M(CuO)和反应前后B管、D管、E瓶、G瓶的质量差(分别用M B、MD、ME、MG表示),且已知CuO全部参加反应,请将求算Cu的相对原子质量的数据组合和表达式填入下表(不一定填满):
| 数据组合 | Cu的相对原子质量的表达式 |
(5)若去掉D装置,则应选用(4)中哪组数据组合求得的铜的相对原子质量较精确?
______ 。
四、(本题3小题,共22分)
21.(8分)(14分)工业上早在十九世纪中叶便已生产过氧化氢,随着人们生态环境的保护意识增强而日益被重视, 过氧化氢成为社会需求量迅速增长的化学品, 过氧化氢是是一种绿色氧化剂,延伸产品及其应用进展迅速。
(1)有人把氯气通入过氧化氢(H218O2)的水(H2O)中,发生反应
Cl2+ H218O2=H++Cl-+H18O18OCl H18O18OCl= H++Cl-+18O2
对上述反应的说明错误的是 。
A. 氯气通入过氧化氢溶液产生的氧气全部来自过氧化氢
B.氯气通入过氧化氢溶液发生的反应可表示为 Cl2+ H2O2=2HCl+ O2
C.过氧化氢有氧化性
D.反应中过氧化氢中的氧原子之间的化学键未变
(2)在冶炼铜时,需要把粗铜溶解,可用:a.浓硫酸 b.焙烧后用稀硫酸 c. 过氧化氢和稀硫酸,某工厂最终选择用c方法。
①写出用c方法溶解铜的化学方程式: 。
②简述最终选择用c方法的理由:
。
③过氧乙酸(CH3COOOH)是常用的一种杀菌消毒剂,它可通过乙酸和过氧化氢反应制得,其化学方程式是 。
22.(14分)A、B两种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1溶液中水的电离程度小于A2溶液中水的电离程度,B1溶液中水的电离程度小于B2溶液中水的电离程度:
(1)写出化学式A1___________A2________________ B1______________________B2___________________。
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的H+的物质的
量浓度之比为_____________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_____________ 。
(4)若 B1、B2两溶液的 pH= 5,则两溶液中水电离出的 H+的物质的量浓度之比为
_______ 。
五.(本题包括2小题,共18分)
23.(8分)除羟基连在 C= C的碳原子上的情况外,C3H6O的同分异物体共有 7种它们的结构式为:
![]() ,CH2=CH-O-CH3,
,CH2=CH-O-CH3, 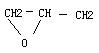 ,_____________,____________,
,_____________,____________,
______________________,___________________________。
24.(10分)A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含有一种官能团,且每个碳原子上最多只连一个官能团:A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是 ,其结构简式是 。
(2)写出A与乙酸反应的化学方程式: 。
(3)写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是 。
六、(本题包括二小题,共19分)
25. (7分)将Na2CO3和NaHCO3的混合物5.48g加热到质量不再减轻时,测得残留固体4.24g。另取一定质量的此混合物固体,跟 100 mL某浓度的盐酸刚好完全反应,并收集到 672 mL CO2气体(标准状况下),求;
(l)此混合物中NaHCO3的质量分数;
(2)所用盐酸的物质的量浓度。
26.(12分)已知高温下能发生如下反应SiO2+2C==Si+2CO↑,Si+C==SiC, 现有石英砂和碳粉的混合物 l mol,在高温电炉中隔绝空气充分反应完全后,冷却得到残留固体。若石英砂与混合物的物质的量之比为x(0<x<1), 试讨论x的取值范围,残留固体的成分和物质的量, 并将结果填入下表:
| 编号 | ① | ② | ③ | ④ | ⑤ |
| x值 | x= | ||||
| 残留固体及 物质的量 | Si |
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | C | B | A | B | B | B | C | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BC | AC | B | D | BC | BD | B | D | AC |
三、19. (1)试管、铁架台、酒精灯、带导管的橡皮塞。( 3分)
(2) 将褪色后的溶液加热, 看能否恢复原来颜色。如恢复原来的颜色,则乙同学的分析正确,如不恢复原来的颜色,则甲同学的分析正确。( 3分)本小题共6分
20. (1)aijghfec(或b)b(或c)kld ( 3分)
(2) 使分液漏斗中与烧瓶中的压强相等, 使点燃气体的操作更安全( 2分)
(3) 无沉淀析出 除去CO2并证明CO的氧化产物。( 2分)
(4) ( 以下每空1分)
| 数据组合 | Cu的相对原子质量的表达式 |
| M(CuO) 与MB |
|
| M(CuO) 与MG |
|
(5)M(CuO) 与MB( 2分) 本小题共13分
四、21. (1) C (2)①Cu+H2O2+H2SO4=CuSO4+ 2H2O
②反应迅速,无污染③CH3COOH+ H2O2 →CH3COOOH+ H2O 每空2分 本小题共8分
22.(1) NaOH、NaNO2 、HNO3、NH4NO3 (2) 1:1
(3) H+控制电离,NH4+水解促进电离 (4)1×10-4:1( 每空2分) 本小题共14分
五、
23. CH3CH2CHO CH2 =CHCH2OH CH2-CH-CH2 CH2-CH-OH( 每空2分)
\ / \ /
O CH2 本小题共8分
24. 解:(1)C:H:O=44.1%/12:8.82%/1:(100%-44.1%-8.82%)/16=5:12:4
其最简式是C5H12O4, 氢已饱和, 最简式即分子式。
A结构简式:C(CH2OH)4 ( 每空2分)
|
![]() (2) C(CH2OH)4+CH3COOH C(CH2OOCCH3)4 +4H2O (2分)
(2) C(CH2OH)4+CH3COOH C(CH2OOCCH3)4 +4H2O (2分)
(3) CH3CH(OH) CH(OH) CH(OH)CH2OH, CH2(OH) CH2 CH(OH) CH(OH)CH2OH
(每个2分) 本小题共10分
六.
25. 解:(1)设混合物中含NaHCO3的质量为x
|
2NaHCO3
Na2CO3+CO2
↑+ H2O 质量减少△m
168g 62g
x 5.48g-4.24g=1.24g
x=3.36g
ω(NaHCO3)=![]() ×100%=61.3%
(3分)
×100%=61.3%
(3分)
(2)由(1)的计算结果可知:
n(NaHCO3):n(Na2CO3)=2:1
NaHCO3 + HCl == NaCl+CO2 ↑+ H2O
2n(Na2CO3) 2n(Na2CO3)
Na2CO3 + 2HCl == 2NaCl+CO2 ↑+ H2O
n(Na2CO3) 2n(Na2CO3)
2n(Na2CO3)+ n(Na2CO3)==0.03mol n(Na2CO3)=0.01mol
故消耗HCl的总的物质的量为0.04mol,
c(HCl)=0.4mol·L-1 (4分)本小题共7分
26. ②x=![]() SiC
SiC ![]() mol
mol
③![]() <x<1
Si
<x<1
Si ![]() mol SiO2
mol SiO2
![]() mol
mol
④![]() <x<
<x<![]() Si(4x-1)mol SiC(1-3x)mol
Si(4x-1)mol SiC(1-3x)mol
⑤0<x<![]() SiC x mol C (1-4x) mol (每项3分) 本小题共12分
SiC x mol C (1-4x) mol (每项3分) 本小题共12分