高三化学复习学案-溶解度曲线
张家港高级中学 王旭红
一、考纲要求
1、会查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2、理解温度对溶解度的影响及溶解度曲线表示的意义。
二、双基回顾
(一)溶解度曲线上点的意义
1.溶解度曲线上的点表示物质 ,溶液所处的状态 。
2.溶解度曲线下面的面积上的点,表示溶液所处的状态是 状态。
3.溶解度曲线上面的面积上的点,依其数据配制的溶液为对应温度时的 溶液,且该溶质有剩余。
4.两条溶解度曲线的交点,表示在该点所示的温度下,两种物质的 相等。
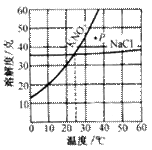 如:右图为硝酸钾和氯化钠的溶解度曲线。由图可知:
如:右图为硝酸钾和氯化钠的溶解度曲线。由图可知:
(1)当温度______时,硝酸钾与氯化钠的溶解度相等。
(2)当温度______时,氯化钠的溶解度大于硝酸钾的溶解度。
(3)图中P点表示KNO3对应的溶液是______
(4)当温度为10℃时,硝酸钾的溶解度是______ 。
(二)溶解度曲线变化规律
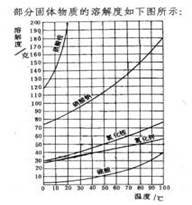 1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如 。
1.大多数固体物质的溶解度随湿度升高而增大,曲线为"陡升型",如 。
2.少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如 。
3.极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",如 。
4.气体物质的溶解度均随湿度的升高而减小(纵坐标表示体积),曲线也为"下降型",如氧气。
(三)溶解度曲线的意义
固体的溶解度曲线可以表示如下几种关系:
(1)同一物质在不同温度时的不同溶解度的数值;(2)不同物质在同一温度时的溶解度数值;
(3)物质的溶解度受温度变化影响的大小;(4)比较某一温度下各种物质溶解度的大小等。
如:右图是A、B、C三种物质的溶解度曲线
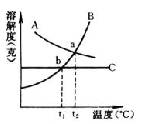 (1)溶解度受温度变化影响最小的是
。
(1)溶解度受温度变化影响最小的是
。
(2)a点说明A、B两物质的溶解度在t2℃时 。
(3)当温度低于t1℃时,A、B、C三种物质的溶解度大小关系为
(4)当温度由t2℃降低到t1℃时,从B和C的饱和溶液中所得到晶体的质量大小关系为 。
三、例题评析
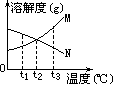 例1、右图是M、N两种不含结晶水的固体物质的溶解度曲线。下列说法中正确的是(
)
例1、右图是M、N两种不含结晶水的固体物质的溶解度曲线。下列说法中正确的是(
)
A、t1℃时,N比M的溶解度大
B、温度从t1℃升高到t3℃时,N的饱和溶液中溶质的质量分数将增大
C、M比N的溶解度大 D、N中含有少量M时,可用降温结晶法提纯N
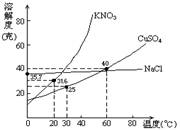 例2、如图:是几种盐的溶解度曲线。下列说法正确的是( )
例2、如图:是几种盐的溶解度曲线。下列说法正确的是( )
A、400C时,将35g食盐溶于100g水中,降温至00C时,可析出氯化钠晶体
B、200C时,硝酸钾饱和溶液的质量分数是31.6%
C、600C时,200g水中溶解80g硫酸铜达饱和。当降温至300C时,可析出30g硫酸铜晶体
D、300C时,将35g硝酸钾和35g食盐同时溶于100g水中,蒸发时先析出的是氯化钠晶体
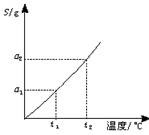 例3、摩尔质量为M
g·mol-1的某物质溶解度曲线如右图所示,现有t2℃时300
g该物质的溶液,恒温蒸发掉50
g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ
g·cm-3,则其物质的量浓度为
mol·L-1。若将饱和溶液降温到t1℃,析出晶体(不含结晶水)的质量为
。
例3、摩尔质量为M
g·mol-1的某物质溶解度曲线如右图所示,现有t2℃时300
g该物质的溶液,恒温蒸发掉50
g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ
g·cm-3,则其物质的量浓度为
mol·L-1。若将饱和溶液降温到t1℃,析出晶体(不含结晶水)的质量为
。
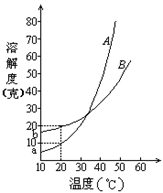 例4、A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
例4、A、B两种化合物的溶解度曲线如右图。现要用结晶法从A、B混和物中提取A。(不考虑A、B共存时,对各自溶解度的影响。)
(1)取50克混和物,将它溶于100克热水,然后冷却至20℃。若要使A析出而B不析出,则混和物中B的质量百分比(B%)最高不能超过多少?(写出推理及计算过程。)
(2)取W克混和物,将它溶于100克热水,然后冷却至10℃。若仍要使A析出而B不析出,请写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式。(以W、a、b表示。只需将答案填写在下列横线的空白处.)
当W<a+b时,A%
当W>a+b时,A%
。
四、课堂练习
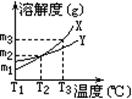 1、X、Y两种固体物质的溶解度曲线如右图。下列说法中错误的是( )
1、X、Y两种固体物质的溶解度曲线如右图。下列说法中错误的是( )
A、X的溶解度大于Y的溶解度
B、T3℃时,100g水中溶解了m2gX,降温至T2℃时溶液可恰好达到饱和
C、T3℃时,100g水中溶解了m3gX,降温至T2℃时可析出(m3-m2)g晶体(不含结晶水)
D、T2℃时,X与Y的溶解度相同
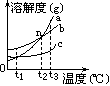 2、a、b、c三种物质的溶解度曲线如右图所示。
2、a、b、c三种物质的溶解度曲线如右图所示。
(1)t1℃时三种物质的溶解度的大小顺序是______ 。
(2)t3℃时,将a、b、c分别溶解在50g水中,均形成了饱和溶液,冷却到t1℃时析出晶体最多的是______。 (3)n点表示______。
(4)为从混有少量c的a中提纯a,可采用_____ 法。
(5)t1℃时,取50ga的饱和溶液,将其温度升高到t2℃时溶液中a的质量分数将______(填“变大”或“变小”或“不变”)。
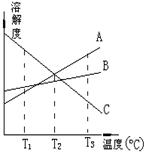 3、T3OC时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如右图.从T3降至T1,下列有关说法正确的是( )
3、T3OC时,将A、B、C三种物质分别溶于100克水中,制成饱和溶液.这三种物质的溶解度随温度而变化的曲线如右图.从T3降至T1,下列有关说法正确的是( )
A.T3OC时,由A物质所形成的溶液的物质的量浓度最大
B.T2OC时,由A、C两物质形成的溶液质量分数相等
C.T1OC时,由B物质所形成的溶液质量分数最大,C的最小
D.T1OC时,由A物质所形成的溶液的质量分数最小
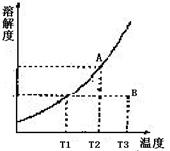 4、溶解度曲线中的任何一点都表示溶液的一种特定状态。当溶液状态发生变化时,表示溶液状态的点的位置(坐标)也将发生相应的改变。某固态物质的溶解度曲线如图所示,试根据图回答下列问题。
4、溶解度曲线中的任何一点都表示溶液的一种特定状态。当溶液状态发生变化时,表示溶液状态的点的位置(坐标)也将发生相应的改变。某固态物质的溶解度曲线如图所示,试根据图回答下列问题。
(1) A点的意义是______。
(2)若A、B两点的溶液在保持温度不变的情况下各加20g水,A点的溶解度将______(填“增大”或“减小”或“不变”),A、B的溶液中溶质的质量分数______(填“前者大”或“后者大”或“相等”)。
(3)当处于A、B点状态的该溶液分别发生下列变化(其他条件不变)时, 试参考表中例示描述A、B点的变动过程。
| A点的变动 | B点的变动 | |
| ①升高温度 | 向右平移 | |
| ②降低温度 | ||
| ③蒸发溶剂 | ||
| ④稀释溶液 |
(4)将该溶液从状态A改变为B有多种途径。试设计并简述一操作最简单、结果最准确的实验途径:
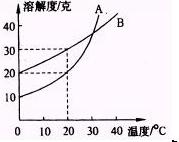 五、拓展训练(课后)
五、拓展训练(课后)
A、B两化合物的溶解度曲线如图所示.现欲用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响).取m g(大于30g)混合物,将它溶于50g热水中然后冷却至20℃,要使A析出,而B不析出,试证明混合物中B的质量分数最高不超过15/m×100%.
高三化学复习学案-溶解度曲线答案
双基回顾
(一) (1)等于25(2)小于25(3)不饱和(4)20克
(三) (1)C (2)相等 (3)A>C>B (4)B>C
例题评析
例1、解析:由图可看出,t1℃时N比M的溶解度大,(A)正确。因N的溶解度随温度的升高而降低,故从t1℃升高到t3℃时N的饱和溶液中溶质的质量分数将减小,(B)错。温度高于t2℃时M的溶解度大于N,温度低于t2℃时,M的溶解度小于N,(C)错。N中含有少量M时,可用升温结晶法提纯N,(D)错。本题的答案为(A)。
例2、D
例3、![]()
![]() g
g
例4、 (1)在20℃时,若要B不析出,该溶液中B的质量不能超过20克,由于A、B质量共50克,所以这时A的质量超过30克,大于它的溶解度,A析出,符合题意。即50克×B%≤20克,B%≤40%或B%<40%。
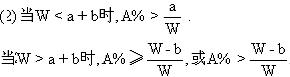 (2)
(2)
课堂练习
1、A
2、(1)b>c=a (2)a (3)t2时a、b的溶解度相等 (4)降温结晶(5)不变
3、C
4、:(1)表示T2时该物质溶解度为S2g
(2)不变 前者大
(3)
|
|
| |
|
|
| 向右平移 |
|
| 沿曲线下移 | 向左平移至曲线,再沿曲线下移 |
|
| 不动 | 垂直上移至曲线,不再变动 |
|
| 垂直下移 | 垂直下移 |
(4)将A状态的该溶液降温至T1,过滤除去析出的该物质晶体后,将溶液升温至T3
拓展训练
设m g混合物中含A物质mA g,含B物、质mB g.B的质量分数为wB.
由溶解度曲线可知:
20℃如B不析出,mB≤30/100×50g,即mB≤15g
20℃如A不析出,mA≤20/100×50g,即mA≤10g
依题意有如下关系式
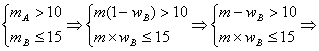
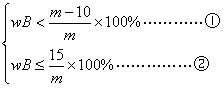
由于m g大于30g,综合①、②,可得wB≤100%.
故混合物中B的质量最高不超过15/m×100%.