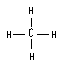
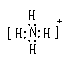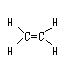高三化学基本概念(下)
主要内容:
1.了解和总结常见的化学用语(化学式、最简式、电子式、结构式、结构简式)
2.掌握常用化学量(原子量、式量、摩尔)
3.理解化学基本定律(质量守恒定律、阿佛加德罗定律及推论)及其应用
二、学习指导
(一)化学用语
1.区分元素符号不同方位数字表达的含义
 元素化合价
元素化合价
该原子质量数 离子所带电荷数
±n
A n±
微粒个数 α
Z m
元素核电荷数 分子中原子个数
2.辨别表示物质组成或结构式子的优劣
| 意义 | 不足 | 实例 | ||||
| 最简式 | 能表示各原子或离子最简比 | 不能确定具体个数 | 乙烷CH3氯化钠NaCl | |||
| 分子式(化学式) | 能表示分子的组成 | 不能反映原子间成键情况 | H2O C2H4 | |||
| 电子式 | 能表示原子、离子、分子、基等其中各原子最外层电子数及成键形式 | 不能说明分子的空间构型 |
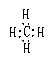 | |||
结构式 | 能反映分子中各原子间结合方式 | 不能表明未成键电子情况 不能说明分子的空间构型 |
| |||
| 结构简式 | 反映结构、突出官能团、省去单键 | 不能说明分子的空间构型 | 乙烯 H2C=CH2 乙醇CH3CH2—O—H |
注意:用电子式表示物质的形成过程
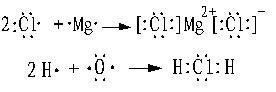 |
无论形成的是离子化合物还是共价化合物,左边均是原子的电子式,右边是该物质的电子式。
(二)化学量
1.比较元素原子量和原子原子量
 原子原子量
元素的原子量(平均)
原子原子量
元素的原子量(平均)
Mi-
![]() -A1..a%+A2.b%+……
-A1..a%+A2.b%+……
原子近似原子量 元素的近似原子量(平均)
![]() =质量数=Ai
=质量数=Ai
![]() =A2.a%+A2.b%+……
=A2.a%+A2.b%+……
由此可知:对于有同位素的元素来说
(1)原子的原子量≠原子的质量数≠元素原子量
(2)质量数针对原子而言,元素无质量数
(3)元素的原子量不仅与其各同位素原子量有关,还与其在自然界中所占的原子百分比有关。
(4)原子百分比(a%、b%…)指各种原子的个数百分比或物质的量百分比,而非质量百分比,但两者可换算。
2.式量与摩尔质量
| 式量 | 摩尔质量 | |
| 概念 单位 | 化学式中所有原子原子量总和 无 | 1mol物质具有的质量 g/mol |
| 关系 | 数值相等 | |
3.物质的量及阿佛加德罗常数(NA)
①物质的量是一个基本物质量,单位:mol
②某物质含有阿佛加德罗数个构成该物质的微粒,该物质的物质的量为1mol
③构成该物质的微粒是指保持其化学性质的微粒。如
1mol纯硫酸含NA个H2SO4个分子
1molNaCl则含NA个Na+、NA个Cl—
④NA=12g碳所含![]() 的原子数≈6.02×1023个/mol
的原子数≈6.02×1023个/mol
4.气体摩尔体积:
概念:在标准状况下(S.T.P),1mol任何气体所占的体积都约是22.4L.
①标准状况0℃(273K)、1.01×105Pa.
②任何气体:指可为纯净物,也可以互不反应的混合气体
③单位:L/mol
小结:物质的量与基本化学量间的关系
 微粒数N(个)
微粒数N(个)
气体体积 ×22.4(L/mol) 物质的量 ÷V(L) 物质的量浓度
V0(L) S.T.P n(mol) C(mol/L)
×M(g/mol)
物质的质量m(g)
关于式:
n=![]() =
=![]() =
=![]() =C.V
=C.V
(三)基本定律
1.阿佛加德罗定律及推论的应用
由PV=nRT=![]() RT变形可得
RT变形可得
PM=![]() RT=ρRT
RT=ρRT
(1)标况时 M=22.4ρ0(ρ0指标况下气体密度)
(2)同温同压时:
![]() =
=![]() =
=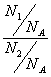 =
=![]() (N1、N2指气体分子数)
(N1、N2指气体分子数)
若V1=V2,则n1=n2,N1=N2 ——即阿佛加德罗定律
(3)同温同压时:![]() =
=![]() =D相(相对密度)
=D相(相对密度)
若m1=m2,则![]() =
=![]() =
=![]()
若V1=V2,则![]() =
=![]() =
=![]()
(4)同温同体积容器中:
![]() =
=![]()
若m1=m2,则![]() =
=![]()
应用:混合气体的平均摩尔质量
(1)已知混合气体在标况时密度
![]() =22.4ρ0
=22.4ρ0
(2)已知混合气体各成分的式量及物质的量或物质的量分数或同温同压下体积分数
![]() =
=![]() =∑Mi·ni%=∑MiVi%
=∑Mi·ni%=∑MiVi%
(3)已知混合气体各成分的式量及质量百分数
![]() =
=![]() =
=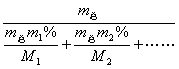
=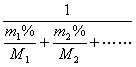
(4)已知混合气相对于另一种式量为M的气体密度(相对密度D)(相同条件)
![]() =D.M
=D.M
2.质量守恒定律
定律:参加反应的各物质质量总和=反应生成物的质量总和
本质:反应前各种原子的种类及个数相同
意义:是书写化学方程式及其计算的依据
三、典型例题讲评
例1.固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层子结构。该物质适当加热就分解成两种气体。试回答下列问题:
(1)固体A属于_________ 晶体,它的电子式为_________
(2)A溶于水后,溶液呈________性(酸、碱或中性),其原因是(用化学方程式表示)
解析:化学式为NH5的物质,学生常简单地认为其结构简式应为:
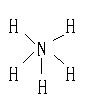 |
从该结构式中可看出,N原子最外层有5对共用电子对,共10个电子,不合题意,联系NH4Cl可较易推测出。
(1)A为NH4H,其电子式为 属离子晶体。
(2)溶液呈碱性。 NH4H+H2O=NH3·H2O+H2↑
例2.某固体A在一定湿度下分解生成固体B、气体C和气体D
A(s)===B(s)+C(g)+4D(g)
若测得生成的气体的质量是同温同压下相同体积氢气的10倍,且当所所气体在标准状况下的体积为22.4L时,所得B的质量为30.4g,则A的摩尔质量是( )
A.130.4g/mol B.50.4g/mol C.182.4g/mol D.252g/mol
解析 该反应涉及到不同状态的物质,气体物质C和D组成的混合物的![]() =20g/mol
=20g/mol
B(s) ~C(g) +4D(g)
MB 5mol
30.4g 1mol
MB=30.4×5=152(g/mol)
故 MA=MB+5![]() =152+5×20=252(g/mol)
=152+5×20=252(g/mol)
本题正确答案为D
例3.120℃、101.3gkpa条件下,有2LH2O、2LCO、1LCO2、0.5LO2和1LH2组成的混合气体.将混合气体通过分别放有足量Cu粉、C粉和CuO粉的三个灼热的反应管.假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
(1)尾气是否有可能是单一气体?________(填“可能”或“不可能”).若可能,该气体是__________
(2)原气体中是否有几种(或一种)不可能再存在于尾气之中?__________(填“有”或“没有”)若有.它们(或它)是______________.
(3)原气体中是否有几种(或一种)肯定存在于尾气中?_________(填“有”或“没有”).若有,它们(或它)是____________.
解析 本题有三个反应管,若按不同顺序排列可能有6种情况.若一一讨论,则费时费力。
现以质量守恒考虑,无论三种物质先后怎样,只有消耗O2的反应而无生成O2的反应且三种固体均足量,故最后尾气中肯定不会有O2.
又H元素不会以固体的形式留在反应管中,最终可能以H2也可能以H2O形式出现,但两者不会共存于尾气中同理,原气体中的CO、CO2中的C元素也不可能留在反应管中,最终可能以CO或CO2形式存在于尾气中.
答案:
(1)不可能
(2)有,O2
(3)没有
例4.下列说法正确的是( )
A.标准状况下,以任意比例混和的甲烷和丙烷的混合物22.4L,所含的分子数约为NA个
B.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为![]() NA个
NA个
C.常温常压下,1mol氦气含有的电子数为4NA
D.1Lmol/L的盐酸中含1molHCl分子
解析 A.根据气体摩尔体积可知,1mol任意气体(可分混合气)含NA个分子,故A正确
B.辛烷(C8H18)在通常情况下已为液体,在标准状况下,更不会是气体.
C.氦气为单原子分子(He),1mol氦气所含电子数应为2NA个
D.盐酸溶液中无HCl分子
本题正确答案:A
巩固练习
(一)选择题:
1.N的质量数为14,在微粒[NH3T]中,电子数、质子数、中子数之比为( )
A.10 :7 :11 B.10 :11 :9 C.10 :11 :8 D.11 :9 :10
2.NH![]() 溶于重水后,生成的一水合氨和水合氢离子均正确的是( )
溶于重水后,生成的一水合氨和水合氢离子均正确的是( )
A.NH2D·H2O和D3O+ B.NH3·DHO和D3O+
C.NH3·D2O和HD2O+ D.NH2D·DHO和DH2O+
3.某元素M形成气态单质分子M2有三种,其分子量依次为70、72、74,其物质的量之比为9 :6 :1,下列说法正确的是( )
A.元素M存在三种同位素
B.M的一种同位素原子质量数为36
C.质量数为35的同位素其原子百分含量为755
D.M2的平均分子量为72
4.已知碳元素存在三种同位素12C,13C,14C,氧有两种同位素:16O和18O,它们可以组成分子量不同的二氧化碳分子的种数为( )
A.5 B.6 C.7 D.8
5.化学反应:aM+bN=cW+dE,已知20gM和10.5gN恰好完全反应,生成16.5gE,则M与W的摩尔质量之比为( )
A.10a :7c B.7a :10c
C.10c :7a D.7c :10a
6.6.8gA物质和19.6gB物质完全反应生成6.4gC物质、0.2molD物质、7.2gE物质,则D的摩尔质量为( )
A.12.8g B.64g C.32g/mol D.64g/mol
7.A、B、C3种物质各15g,发生如下反应:A+B+C→D,反应停止后生成D30g,然后在残留物中加入10gA,反应又继续开始,待反应再次停止后,反应物中只余C.根据上述推断,下列说法正确的是( )
A.第一次反应停止时B剩余9g
B.第一次反应停止时C剩余6g
C.反应中A和C的质量比是5 :3
D.第二次反应后C剩余5g
8.在一定体积的容器中加入1.5mol氙气和7.5mol氟气,于400℃和2633Kpa压强下加热数小时,然后迅速冷至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气则所得无色晶体产物中,氙和氟的原子个数之比是( )
A.1 :6 B.1 :4 C.1 :3 D.1 :2
9.把氢氧化钠滴入相同物质的量浓度的硫酸铜溶液中有沉淀生成,由实验可知,氢氧化钠溶液和硫酸铜的体积比3 :2时,残留在溶液中的Cu2+的量极小(可以认为Cu2+全部沉淀)此时生成的沉淀的化学式可能是( )
A.Cu(OH)2 B.Cu2(OH)2SO4 C.CuSO4·5H2O D.Cu4(OH)6SO4
10.某非金属X的最低负价为-m,它的最高氧化物对应的水化物分子中有b个氧原子,则这种酸的分子式为( )
A.H2b-8+mXOb B.H2b-8-mXOb C.H -2b-m+8XOb D.Hm+8+2bXOb
11.下列说法正确的是( )
A.2.3gNa变为Na+时,失去0.1NA个电子
B.18g重水(D2O)所含的电子数为10NA个
C.28g氮气所含原子数为NA个
D.20℃.1.01×105Pa时,11.2LO2所含的原子数为NA个
12.下列事实中能说明氯的单质是双原子分子的是( )
A.氯气在水中部分反应,生成等物质的量HCl和HClO
B.氯原子的最外层上有7个电子
C.电解NaCl水溶液,每得到2g氢气,则可得到71g氯气
D.在标准状况下,71g氯气占有22.4L体积
13.在进行气体体积的有关计算中,被研究的气体实际体积与计算值十分接近,由此可见这种被研究的气体所处的状态是( )
A.低温高压 B.高温高压 C.低温低压 D.高温低压
14.下列说法正确的是( )
A.1.6gNH![]() 所含的电子数为NA个
所含的电子数为NA个
B.0.5LPH=2的H2SO4溶液中含有NA个H+
C.17g氨中共价键数目为NA
D.2NA个硫酸分子与196g磷酸含相同的氧原子
15.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积为33.6L(S.T.P),在所生成的气体中,D和H的原子个数比是( )
A. 1 :2 B. 2 :3 C.1 :3 D.2 :5
16.如果mg氨气含x个原子,则2mg硫化氢中含有的分子数为( )
A.0.25x B.0.5x C.2x D.4x
17.下列物质中含原子个数最多是( )
A.0.4molO2 B.5.6LCO2(S.T.P)
C.4℃时5.4mLH2O D.10gNe
18.在标准状况下,下列气体中密度最小的是( )
A.4.48LN2O B.140gCO
C.1LCl2 D.1.5molH2S
19.在标准状况下,质量相同的气体A和B,B的体积小于A的体积,则它们的分子量(MA、MB)的相互关系是( )
A.MA>MB B.MA=MB
C.MB>MA D.无法确定
20.气体A与气体B的摩尔质量之比为4 :1,则它们在同温、同压、同体积时,A与B的分子个数比为( )
A.4 :1 B.1 :4 C.1 :1 D.2 :1
21.同温同压下质量相同的气体,其密度与下列各量的关系中成立的是( )
A.与所占体积成正比
B.与其物质的量成正比
C.与其物质的质量成正比
D.与其摩尔质量成正比
22.质量相同的两种气体A和B,在相同条件下,A的密度小于B,下列说法不正确的是( )
A.A占的体积比B大
B.A的物质的量比B多
C.A的分子数比B多
D.A的式量比B大
二、填空题
23.将4mLO2和3mlNxHy(y>x)混合气体在150℃和1.05×105Pa下点燃,完全反应后,恢复到原来的温度与压强时,测得反应后N2、O2、H2O(g)混合气体比原混合气体的密度减少3/10.
(1)此反应的化学方程式是(用NxHy表示)__________________________
(2)推算NxHy化学式的根据是_________________
(3)x与y的关系式为__________________
24.金属X和非金属Y可直接化合生成化合物XY,甲、乙、丙三人分别做X和Y的化合实验,充分反应时每人所用X和Y的质量各不相同,但总质量均为10g.有关实验数据如下表:
| X用量 | Y用量 | 得XY量 | |
| 甲 | 8g | 2g | 8g |
| 乙 | 6g | 4g | 8g |
(1)利用表中数据判断X和Y反应时,X和Y的质量比为___________
(2)若丙同学在实验中得到6gXY,则丙同学X和Y的用量分别是_________、________
25.化合物E(含两种元素)与NH3反应,生成化合物G和H2,化合物G的式量约为81;G分子中硼元素(B原子量为10.8)和氢元素的质量分数分别是40%和7.4%由此推断:
(1)化合物G的分子式为____________
(2)反应消耗1molNH3,可生成2molH2,组成化合物E的元素是_______和______
(3)1molE和2molNH3恰好完全反应,化合物E的分子式为________
26.从某些方面看,氨和水相当,NH![]() 和H2O+(常写成H+)相当,NH
和H2O+(常写成H+)相当,NH![]() 和OH—相当,NH2—(有时还包括N3—)和O2—相当,已知在液氨中酸发生下列两个反应:
和OH—相当,NH2—(有时还包括N3—)和O2—相当,已知在液氨中酸发生下列两个反应:
(1)NH4Cl+KNH2=KCl+2NH3
(2)2NH4I+PbNH=PbI2+3NH3
请写出能在水溶液中发生与上述两个反应相当的反应方程式(1)_________________(2)___________________.
三、实验题
27.为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均相对分子质量,设计了下面的实验:
①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得质量m1(质量单位:g下同);
②往锥形瓶内通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m2;
③往锥形瓶内加满水,塞好胶塞,称量得到质量m3.
已知实验时的温度压强不变(未测定具体数值),水的密度为ρ(水)g·L—1,空气的平均相对分子质量为29.0,空气的密度为ρ(空气)g·L—1,
回答下列问题:
(1)本实验的原理是(用文字具体说明)________________________________
____________________________________________________________________
(2)步骤②中为什么要复操作,直到前后两次称量结果基本相同?
____________________________________________________________________
(3)第一次称量前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上做一记号,以后每次测量时胶塞塞入瓶口的位置都以为准,目的是:
______________________________________________________________________.
(4)本实验中收集样品的操作,可选用的方法是(填图中标号)___________.
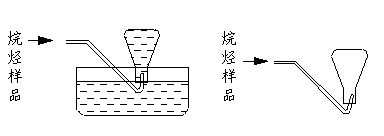 |
A B
 |
C D
(5)锥形瓶内空气的质量[m(空气)]用m1、m3、ρ(空气)、ρ(水)表示为_________.
(6)瓶中样品质量用m1、m2、m(空气)表示为_____________.
(7)由实验测得该烷烃的平均相对分子质量用m1、m2、m(空气)表示为_________.
参考答案
(一)1.B 2.B 3.C 4.C 5.C 6.D 7.D 8.B 9.D 10.A
11.A 12.D 13.D 14.D 15.C 16.A 17.C 18.B 19.C
20.C 21.D 22.D
(二)23.(1)NxHy+Yo2=2×N2+2yH2O
(2)质量守恒定律和阿佛加德罗定律
(3)2x+y=8
24.(1)3 :1 (2)![]()
![]()
25.(1)B3N3H6 (2)B,H (3)B2H6
26.(1)HCl+KOH=KCl+H2O
(2)2HI+PbO=PbI2+H2O
三、(1)根据阿佛加德罗定律,同温同压同体积的不同气体的质量之比等于它们的相对分子质量之比
(2)为了保证瓶内的空气完全排出,并充满样品气体
(3)确保每次测量都在相同的体积下进行
(4)D (5)(m3-m1)·ρ(空气)/ρ(水)
(6)m2-m1+m(空气)
(7)29.0×(m2-m1)/m(空气)+29.0