高三化学金属通论及碱金属
教学内容
1. 掌握金属的一般原子结构特征、金属活动顺序及其应用。
2. 掌握碱金属相似性、递变性和特殊性.
3.掌握以Na为代表的碱金属知识网络
4. 比较钠的两种氧化物、两种碳酸盐
二、学习指导
(一)金属概要
1.金属的原子结构及位置特征

 最外层电子数较少(一般≤3) 位于周期表阶梯线左下方
最外层电子数较少(一般≤3) 位于周期表阶梯线左下方
![]() 原子半径较大(同周期)
处于各周期的前中部
原子半径较大(同周期)
处于各周期的前中部
从右→左、上→下,半径增大 越左越下金属性越强
2.金属活动顺序及其应用
| 活动性顺序 | K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au | |||||||||||||
|
| 强 弱 | |||||||||||||
|
| 弱 强 | |||||||||||||
|
| ||||||||||||||
|
H2O 反 应 | 冷水 强碱+氢气 | 热水 碱+氢气 | 高温水蒸汽 金属氧化物+氢气 | |||||||||||
|
| 能置换非氧化性酸中的氢,由快到慢 与非氧化性酸一般不 与强氧化性酸均能反应但无H2生成 反应,溶于王水 | |||||||||||||
| 与盐溶液反应 | 先与水反应后考虑碱与盐反应的可能性 | 排在前面的金属能把其后面的金属 从盐溶液中置换出来 | ||||||||||||
| 冶炼方法 | 电解法 | 还原法 (常见还原剂)H2、CO、C、Al | 加热 分解法 | 物理 富集法 | ||||||||||
3.金属单质制备
金属的活泼性如何,决定了它在自然界的存在形态及冶炼方法.如很活泼金属(Na),常温下与水即反应,故必须在无水体系中采用电化学方法,使其实现Na+→Na.而极不活泼的金属(Au),在自然界中即以单质形式存在,只需用物理方法.较活泼的金属(如Fe),在自然界主要以化合态存在于矿石中,在陨石中可发现单质铁.
![]() 金属单质制备小结:
金属单质制备小结:
|
电解法 (K→Al)
| 2NaCl(熔融) 2Na+Cl2↑ MgCl2(熔融) Mg+Cl2↑ 2Al2O3(熔融) 4Al+3O2↑
| |||||
|
还原法 (Zn→Cu) | H2+CuO Cu+H2O 3CO+Fe2O3 2Fe+3CO2 2Al+WO3 W+Al2O3 3C+Cr2O3 2Cr+3CO | |||||
|
(Hg→Ag) | 2HgO 2Hg+O2↑ HgS+O2 Hg+SO2 |
![]()
注意 Na+KCl K+NaCl
由于沸点:Na>K,符合勒沙特列原理。
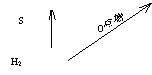
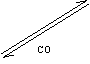
(二)Na为中心的知识网络
HCl

![]()
![]() Na2S Na2O
Na2O2
NaCl
Na2S Na2O
Na2O2
NaCl
 | |||||
 | |||||
![]()

|
|

|
|
|
|
C6H5OH
C2H5ONa K C6H5ONa CH3COONa
(三)碱金属的相似性、递变性
|
|
|
|
![]()
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
区分碱金属投入水中产生现象的异同:
现象: Li Na K Ru、Cs
共同点 浮、熔、游、
气、 红(酚酞) 沉
不同点: 不熔 熔 火球、轻微爆炸 立即燃烧 甚至爆炸
逐渐消失 很快消失
(四)比较钠的两种氧化物
| Na2O | Na2O2 | |
|
电子式 | Na+[ ]2-Na+ | Na+[ ]2-Na+ |
| 化学键种类 | 离子键 | 离子键、非极性键 |
|
| 2:1 | 1:1 |
|
| 2:1 | 2:1 |
| 类 别 | 碱性氧化物 | 过氧化物(不属碱性氧化物) |
|
状 态 | 白色 固体 | 淡黄色 固体 |
| 生成条件 | 4Na+O2 2Na2O (空气) | 2Na+O2 Na2O2 (空气或氧气) |
| 与H2O反应 | Na2O+H2O=2NaOH | 2Na2O2+2H2O=4NaOH+O2 |
| 与HCl反应 | Na2O+2HCl=2NaCl+H2O | 2Na2O2+4HCl=4NaCl+O2↑+2H2O |
| 与CO2反应 | Na2O+CO2=Na2CO3 | 2Na2O2+2CO2=2Na2CO3+O2 |
(五)比较碳酸钠和碳酸氢钠
| Na2CO3 | NaHCO3 | ||||
| 俗名 | 纯碱、苏打 | 小苏打 | |||
|
成分 | Na2CO3·10H2O (易风化) |
| |||
|
| 易溶于水 (20℃, S=22.2g) | 溶于水 (20℃, S=9.6g) | |||
| 与H+反应 剧烈程度 | CO32-+2H+=CO2↑+H2O HCO3-+H+=CO2↑+H2O | ||||
|
| HCO3-+OH-=CO32-+H2O | ||||
|
热稳定性 | 很稳定 850℃开始 部分分解 | 不稳定 2NaHCO3 Na2CO3+H2O+CO2↑ 180℃完全分解 | |||
三、典型例析:
例1.试分析下列问题
思考1.为什么Li与H2O反应比Na与H2O反应缓慢得多?
思考2.碱金属均可保存在煤油中吗?
解析1:一方面Li的活泼性弱于Na,另一方面是因为生成的LiOH微溶于水,覆盖在Li表面,使Li与H2O的接触面减小,反应速率降低.
值得一提的是:根据周期表中对角线相似规则,Li与Mg的化合物性质有相似性
![]()
![]()
![]() 如 Mg(OH)2
MgCO3 MgF2 难或微溶于水
如 Mg(OH)2
MgCO3 MgF2 难或微溶于水
LiOH Li2CO3 LiF (水溶性相似)
解析2:选择合适的保护液,必须符合以下条件:
① 不能与待保护的物质发生化学反应.
如乙醇能与Na等反应,故不能用醇、酸类等有机物.
② 密度比待保护的物质密度小.
只有让待保护物沉降在保护液下,才能起到不与空气接触的目的(即液封).否则,
浮在液面上,照常与空气接触,故Li不能用煤油保存.,应用石蜡油。
例2.请预测并解释下列实验可能有的现象
实验1:在一试管中加入3mL水,再加入3mL煤油,投入一小块Na.观察到的主要现象是__________
解析:主要现象:分层,煤油层在上,水层在下, Na在两层交界处不停转动,或上浮,后又下落、熔成闪亮小球.放出无色无气味气体. 最终慢慢消失。
原因:钠的密度介于水和煤油间,当钠与水接触即发生反应,产生的气体将钠推动上升。但进入煤油层不与其反应,气体逸出后,重力作用又使钠回落到水层,循环往复,钠块逐渐减小,最终消失。
一
实验2:将大小一样的K、Na放入煤油和水的混合液中,何者先反应完?
解析:钠块钾慢。
原因:
密度 K Na 煤油
0.86 0.97 0.8
产生的气体更易使钾上浮
实验3:
一小块Na投入到饱和澄清石灰水中,有何主要现象?
解析:主要现象:①有气体 ②溶液温度上升③出现混浊
主要原因:钠与水反应使溶液中OH-离子浓增大,且溶液温度升高,Ca(OH)2溶解度减小,溶解平衡逆向移动,导致Ca(OH)2部分析出
实验4:取等量的两小块钠,①将其中一份直接投入水中,②另一份用铝箔包好,刺上多个小孔,用镊子夹住放入水面下,充分反应后,两种操作,反应放出的H2量是否相等?
解析:①Na投入水中,熔成小球浮在水面上,部分Na就会与空气中的O2反应,生成Na2O,Na2O与H2O反应只生成NaOH,无H2放出.从而减少了与H2O反应的Na,也即影响产生H2量.
② Na在水下反应,避免了氧化,同时生成的NaOH又与铝箔反应,能进一步产生H2.
故产生的H2量②>①
例3. 将含O2和CH4的混合气体充入装有23.4g Na2O2的密闭容器中点燃,反应结束后,容器温度为150℃,压强为Opa.将残留物溶于水无气体逸出.下列叙述正确的是( )
A.原混合气体中O2和CH4的体积比为2:1
B.原混合气体中O2和CH4的体积比为1:2
C.残留固体中有Na2CO3和NaOH
D.残留固体中只有Na2CO3
解析 若CH4与O2体积为1:2,则恰好反应,当气体产物通过Na2O2后必有O2生成,不合
题意.
又根据氢、碳元素守恒,反应后的固体必为Na2CO3和NaOH的混合物.
![]() 由题意可知,最终反应后无Na2O2多余,也无气体多余.可用方程式的代数处理来求出CH4和O2的体积比.
由题意可知,最终反应后无Na2O2多余,也无气体多余.可用方程式的代数处理来求出CH4和O2的体积比.
![]()
![]() CH4+2O2 CO2+2H2O
CH4+2O2 CO2+2H2O
CO2+Na2O2=Na2CO3+![]() O2
O2
+ 2H2O+2Na2O2=4NaOH+O2
CH4+
VCH4:VO2=1:![]() =2:1
=2:1
故本题答案:B C
例4.某种H2和CO的混合气体,其密度为相同条件下O2密度的1/2.将3.2g这种混合气充入一盛有足量Na2O2的密闭容器中,再通入过量O2,并用电火花点燃使其充分反应,最后容器中固体的质量增加了( )
A.3.2g B.4.4g C.5.6g D.6.4g
解析 先分析下列两个反应
2Na2O2 + 2H2O = 4NaOH + O2
2Na2O2 + 2CO2 = Na2CO3 + O2
(1)从反应前后气体体积变化进行分析:
2H2O~O2, 2CO2~O2
即:2(H2 O, CO2) ~O2
任意比混合的H2O、CO2通过Na2O2后,其体积总为原体积的一半。
(2)从反应前后固体质量变化进行分析:
Na2O2~2NaOH, Na2O2~Na2CO3
反应过程中过氧化钠吸收了相当于组成为“H2、CO”的成分。
故最后容器中固体质量增加值即H2和CO的混合气体的质量。
从另一种角度看, 2H2+O2 =2H 2O
2CO +O2= 2CO2
燃烧H2 和CO混合气体所消耗的O2与H 2O、CO2和Na2O2反应放出的O2的物质的量相同。
本题答案:A
例5:把ag Na2O和a1g Na2O2分别加入等质量的bg水中(足量),结果得到同浓度的溶液,则a、a1的关系是_________
解析:先看常规方法:
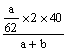 =
=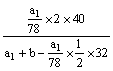
62a1=78a
![]() =
=![]() .
.
计算不便。
再看 特殊方法:
Na2O+H2 O=2NaOH
1 mol 2 mol
Na2O2+H2O=2NaOH+![]() O2
O2
1 mol 2mol ![]() mol
mol
1mol Na2O2比1mol Na2O多1molO,与H2O反应时多余的O以O2形式放出.
结论:等物质的量的Na2O和Na2O2与等量且足量的水反应,得到同浓度的溶液.
本题:n![]() =n
=n![]()
![]() =
=![]() =
=![]()
试一试:
将a1gNa2O溶于b1g水,a2gNa2O2溶于b2g水,均得到8%的NaOH溶液.若a1:a2=31:39.则 b1:b2=__________
答案:1:1
巩固练习
一、选择题(每一小题可能有1-2个选项符合题意)
1、下列物质在空气中易变质,但未发生氧化还原反应的是:
A、Rb B、K2O C、Na2O2 D、Na2CO3·10H2O
2、以下关于金属钠的叙述中正确的是:
A、钠在空气中能发生缓慢氧化而自燃
B、金属钠可保存在煤油中,也可保存在CCl4中
C、钠能和CuSO4溶液反应置换出Cu
D、钠投入水中立即熔化成小球,说明其熔点低且钠与水的反应是放热反应
3、关于氧化钠和过氧化钠的叙述中正确的是:
A、都可与CO2和H2O反应且都有同一种物质生成 B、都能漂白有色物质
C、露置于空气中最终能变成同种物质 D、均能和盐酸反应只生成盐和水
4、氢化锂(LiH)是一种离子化合物,可与水反应放出H2,下列叙述正确的是:
A、水溶液呈酸性 B、水溶液呈碱性 C、微粒半径Li>Li+ D、H-可被还原为H2
5、下列各组离子在同一溶液中能大量共存的组是:
A、H+、Li+、Cl-、OH- B、Na+、Ba2+、OH-、NO3-
C、K+、Na+、HCO3-、OH- D、Cs+、Na+、H+、CO32-
6、鉴别KHCO3和K2CO3粉末,可采用:
A、分别与同浓度的稀盐酸反应 B、分别与NaOH 溶液反应
C、分别加热检验有无气体生成 D、分别滴加石灰水看是否有沉淀生成
7、下列转变中,可以一步实现的是:
A、NaHCO3→Na2O B、NaOH→Cu(OH)2 C、NaNO3→NaCl D、Na2CO3→NaOH
8、下列离子方程式中正确的是:
A、钠和水反应 Na +2H2O = Na+ + 2OH- + H2↑
B、NaHCO3和足量Ca(OH)2溶液反应 Ca2+ + HCO3- +OH- = CaCO3↓+H2O
C、碳酸钙和稀盐酸反应 CO32- + 2H+ = H2O + CO2↑
D、Ba(OH)2和稀硫酸反应 Ba2+ + H+ + OH- + SO42- = BaSO4↓+ H2O
9、下列反应中,需加入氧化剂才能发生的是:
A、Na→NaOH B、Na2CO3→NaHCO3 C、Na2O2→NaOH D、Na2O→NaOH
10、关于Na2CO3、NaHCO3性质的有关叙述正确的是:
A、在水中溶解性:Na2CO3<NaHCO3
B、热稳定性:Na2CO3<NaHCO3
C、与同浓度酸反应的速率:Na2CO3 <NaHCO3
D、Na2CO3不能转化为NaHCO3,而NaHCO3能转化为Na2CO3
11、在下列反应中,Na2O2只表现出强氧化性的是:
![]() A、2Na2O2
+ CO2 2Na2CO3
+ O2
A、2Na2O2
+ CO2 2Na2CO3
+ O2
![]() B、Na2O2
+ MnO2
Na2MnO4
B、Na2O2
+ MnO2
Na2MnO4
![]() C、2Na2O2
+ H2SO4 2Na2SO4
+ 2H2O + O2↑
C、2Na2O2
+ H2SO4 2Na2SO4
+ 2H2O + O2↑
![]() D、5Na2O2
+ 2MnO4- + 16H+ 10Na+
+ 2Mn2+ + 5O2↑+ 8H2O
D、5Na2O2
+ 2MnO4- + 16H+ 10Na+
+ 2Mn2+ + 5O2↑+ 8H2O
12、下列各组中的两物质反应时,反应条件或反应物用量的改变对生成物没有影响的是:
A、Na2O2与CO2 B、Na与O2 C、NaOH与CO2 D、C与O2
13、Na2O2和过量NaHCO3混合,在密闭容器中加热后,最后排出气体后,残留的固体物质是:
A、Na2O和Na2O2 B、Na2O2和Na2CO3 C、Na2CO3 D、Na2O2、NaOH和Na2CO3
14、可用于判断NaHCO3粉末中混有Na2CO3的实验方法是:
A、加热时有无气体放出 B、滴加盐酸时有无气体放出
C、溶于水后,滴加澄清石灰水,有无白色沉淀生成
D、溶于水后,滴加BaCl2溶液,有无白色沉淀生成
15、将CO2气体持续通入下列溶液中,最终有沉淀或晶体生成的是:
A、CaCl2溶液 B、澄清石灰水 C、Na2CO3饱和溶液 D、NaHCO3溶液
16、焰色反应每次实验都要用试剂洗净铂丝,这种试剂是:
A、NaOH溶液 B、硫酸溶液 C、Na2CO3溶液 D、稀盐酸
17、已知钡的活动性介于钾与钠之间,则下列说法能实现的是:
A、钡可从氢氧化钠溶液中置换出钠 B、钡能与水剧烈反应产生氢气
C、钡可以从氯化钾溶液中置换出钾 D、钡与水的反应比钾与水的反应剧烈
18、盛下列物质的容器敞口久置,其质量减少的是:
A、浓H2SO4 B、固体苛性钠 C、Na2O2 D、结晶碳酸钠
19、将一小块钠投入到CuSO4溶液中,不可能有的生成物是:
A、Cu B、H2 C、Cu(OH)2 D、Na2SO4
20、钠和铯都是碱金属元素,下列关于铯及其化合物的叙述不正确的是:
A、无水硫酸铯的化学式为Cs2SO4,它易溶于水
B、碳酸铯加热分解为CO2和氧化铯
C、铯可以从电解它的熔融的氯化物中得到
D、在Na、K、Rb、Cs中,Cs的熔点最低
二、填空题
21、使4.6g金属钠和水完全反应,被还原的水的质量是__________g。
22、有A、B、C、D四种溶液,分别是K2CO3、K2SO4、NaHSO4、Ba(NO3)2中的一种,现进行下列实验:A+C无明显变化;A+D无明显变化;B+D生成溶液及沉淀物E;B+C生成溶液F及沉淀;少量的E溶于过量F中生成溶液并放出气体。则A是________,B是________,C是________,D是________。
23、把CO2通入足量的NaOH溶液中,反应的离子方程式为___________________,
若继续通入CO2直到过量,则发现有细小晶体析出,原因是①_______②______③____,方程式为___________________。该晶体制成的溶液分别与下列物质反应的离子方程式为:①稀H2SO4________________________;②KOH溶液_______________________;③少量澄清的石灰水_______________________。
24、有①Na2CO3、②NaHCO3、③Na2SO4、④NaHSO4四种物质,其中只能与盐酸反应的是___________,只能与NaOH溶液反应的是__________,既能与盐酸又能与溶液反应的是___________。(均填数字)
25、A、B、C三种物质均属于同一种金属的化合物。用铂丝蘸取A、B、C三种物质的溶液,在无色火焰上灼烧,均呈浅紫色(透过蓝色钴玻璃)。已知:A与B反应成为C;加热B得到D;D与A的水溶液反应生成B或者生成C;B可与酸和碱反应。则A是________,B是________,C是________,D是________。
26..四个密闭容器中分别各有1 mol下列物质:
![]()
![]()
![]()
![]() Na2O2
Na2O2
Na2O2
Na2CO3
Na2O2
Na2O2
Na2O2
Na2CO3
① ② ③ ④
NaHCO3 NH4HCO3 Ca(HCO3)2 NaHCO3
现加热至300oC,反应完全后排出气体,四个容器中残留固体物仅为Na2CO3的容器
是______
(三)计算题
27.已知氢化钠与水反应放出氢气.现有氢化钠和铝粉的混合物mg,与足量水充分反应后,收集到的气体为ng,试回答:
(1)若充分反应后得到只含一种物质的水溶液时,该物质是________;则原混合物中氢化钠与铝粉的物质的量之比为________,质量比为________.
(2)当物质的量之比:NaH:Al≤_______时,铝粉质量为_______;当物质的量之比:NaH:Al>_______时,铝粉的质量为________.
28.向铝粉和过氧化钠的混合物中加入足量水振荡,当混合物全部溶解后,待到无色透明
溶液并放出7g气体.向该溶液中滴加5 mol/L的盐酸,有白色胶状沉淀生成,当滴加
至280mL时,沉淀恰好溶解:试求混合物中Al和Na2O2的物质的量各为多少?
参考答案:
(一)1.BD 2.D 3.AC 4.BC 5. B 6. AC 7.BD 8.B 9.A 10.C
11.B 12.A 13.C 14.D 15.C 16.D 17.B 18.D 19.A 20.B
(二) 21.3.6g
22.K2SO4, Ba(NO3)2 , NaHSO4, K2CO3
23.CO2+2OH-=CO32-+H2O,水量减少、生成碳酸氢钠的质量大于碳酸钠的质量、
溶解度:碳酸氢钠小于碳酸钠。CO2+ H2O+Na2CO3 =2 NaHCO3
①HCO3-+H+ = CO2+ H2O ② HCO3-+OH-=CO32-+H2O
③2 HCO3- +Ca2+-+2OH-=CaCO3 + CO32- + H2O
24.①;④;②
25.KOH ,KHCO3, K2CO3, CO2
26. ②④
三、27.(1)NaAlO2; 1:1,8:9 (2)1:1 (m-4.8n)g
1:1 (36n-3m)g
28. Al-0.2 mol, Na2O2-0.4 mol
28
