高三化学离子晶体课后作业(1)
一、选择题
1.下列性质中,可以证明某化合物内一定存在离子键
的是 ( )
A.可溶于水 B.有较高的熔点
C.水溶液能导电 D.熔融状态能导电
2.下列物质中,含有极性键的离子化合物是。
A.CaCl2 B.Na202 C.NaOH D.K2S
3.Cs是IA族元素,F是VIIA族元素,估计Cs和F形成
的化合物可能是
A.离子化合物 B.化学式为CsF2
 C. 室温为固体 D.室温为气体
C. 室温为固体 D.室温为气体
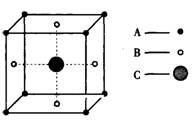
4.某物质的晶体中含A、B、C三种元素,其排列方式
如图所示(其中前后两面心上的B原子未能画
出),晶体中A、B、C的中原子个数之比依次为
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
5.NaF,Nal,MgO均为离子化合物,根据下列数据,这
三种化合物的熔点高低顺序是 ( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
|
| 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
6.在NaCl晶体中与每个Na+距离等同且最近的几个Cl-所围成的空间几何构型为 ( )
A.正四面体 B.正六面体
C.正八面体 D.正十二面体
7.如图是氯化铯晶体的晶胞(晶体中最小的重复单元),已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
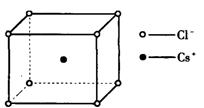
![]()
![]() B.
B.![]()
![]() C.
C.![]() D.
D. ![]()
二、填空题
8.参考下列熔点数据回答:
| 物质 | NaF | NaCl | NaBr | NaI |
| 熔点℃ | 995 | 801 | 755 | 651 |
| 物质 | NaCl | KCl | RbCl | CsCl |
| 熔点℃ | 801 | 776 | 715 | 646 |
钠的卤化物从NaF到NaI及碱金属的氯化物从NaCl到CsCl的熔点逐渐____________这与__________有关。随__________增大__________减小,故熔点__________逐渐 。
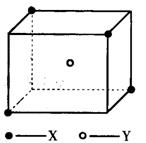 9.某离子晶体晶胞结构如下图所示,x位于立方体的
9.某离子晶体晶胞结构如下图所示,x位于立方体的
顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每
个x同时吸引着__________个Y,该晶体的化学式
为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等
的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角
∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
★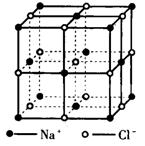 10.晶体具有规则的几何外型、晶体中最基本的重复单
10.晶体具有规则的几何外型、晶体中最基本的重复单
位称为晶胞。NaCl晶体结构如图所示。已知FexO
晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1
测知FexO晶体密度为ρ=5.71 g·cm-3,晶胞边长为
4.28×10-10 m。
(1)FexO中x值(精确至O.01)为
(2)晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和
Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为 ______________。
(3)此晶体的化学式为 _____________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是_____________。
(5)在晶体中,铁元素间最短距离为_____________cm
★11.有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN-离子位于立方体的棱上。
(1)根据晶体结构特点,推出其化学式(用最简单整数表示)__________________________。
(2)此化学式带何种电荷?用什么样的离子(用Mn+表示)与其结合成中性的化学式?写出此电中性的化学式。
答:
(3)指出(2)中添加离子在晶体结构中的什么位置。
答:
12.1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
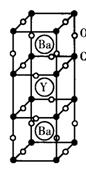
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为Y+3,Ba+2,Cu+2和Cu+3)试计算化合物中这两种价态Cu原子个数比
高三化学离子晶体作业(2)
1.下列物质在变化过程中,只需克服分子间作用力的是 ( )
A.食盐溶解 B.铁的熔化
C.干冰升华 D.氯化铵的“升华”
2.下列化学式能真实表示物质分子组成的是( )
A.NaOH B.S03 C.CsCl D.NaCl
3.最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是 ( )
A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体
C.C60中虽然没有离子键,但固体为离子晶 D.C60相对分子质量为720
4.当S03晶体熔化或气化时,下述各项中发生变化的是 ( )
A.分子内化学键 B.分子间距离 C.分子构型 D.分子间作用力
5.IA族元素的原子与最外层有7个电子的原子结合,可以形成 ( )
A.离子晶体 B.分子晶体
C.离子晶体,分子晶体都不可能形成 D.无法确定
6,支持固态氨是分子晶体的事实是
A.氮原子不能形成阳离子
B.铵离子不能单独存在
C.常温下,氨是气态物质
D.氨极易溶于水
7.下列有关共价化合物的说法:①具有较低的熔、沸点 ②不是电解质 ③固态时是分子晶体 ④都是由分子构成 ⑤液态时不导电,其中一定正确的是
A.①③④ B.②⑤ C.①②③④⑤ D.⑤
8.下列分子晶体:
①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2 熔沸点由高到低的顺序是 ( )
A.①②③④⑤⑥ B.③②①⑤④⑥
C.③②①④⑤⑥ D,⑥⑤④③②①
9.下列性质适合于分子晶体的是 ( )
A.熔点1 070℃,易溶于水,水溶液导电
B.熔点10.31 ℃,液态不导电、水溶液能导电
C.能溶于CS2、熔点112.8 ℃,沸点444.6℃
D.熔点97.81℃,质软、导电、密度0.97 g/cm3
二、填空题
10.有两组关于物质熔点的数据分析以上数据,回答:
| I组 | ||||
| 物质 | NaCl | KCl | RbCl | CsCl |
| 熔点 | ||||
| II组 | ||||
| 物质 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点 | ||||
(1)有什么规律可循______________________________________
(2)造成这些规律的主要原因是 __________________________________________
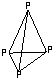 11.已知白磷是由P4分子形成的分子晶体,每个P4分子
11.已知白磷是由P4分子形成的分子晶体,每个P4分子
是正四面体结构。分子中的四个磷原子位于正 四面体的
四个顶点。则P4分子中共有___________个P—P键。
★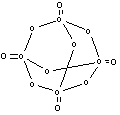 12.磷在空气中充分燃烧后生成结构如图所示的分子。图中
12.磷在空气中充分燃烧后生成结构如图所示的分子。图中
圆圈表示原子、实线表示化学键。试回答:
(1)请从图中找出磷原子,并在图上将其涂黑。
(2)形成化合物的化学式为 ________________。
(3)分子内的磷原子排列成______________形。
(4)每个磷原子处于______________中心。
(5)在用实线表示的化学键中,两原子间单线表示
的是 _________极(填写非极性键或极性键)。
★13. 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
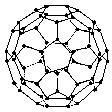 ①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30.请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是:
_________________________________________________________.
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)_________________________,并简述其理由:
________________________________________________________.
(3)通过计算,确定C60分子所含单键数.
C60分子所含单键数为_______________.
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
C70分子中所含五边形数为____________,六边形数为_________.
高三化学离子晶体课后作业(3)
1、下列的晶体中,化学键种类相同,晶体类型也相同的是 ( )
A.SO2与Si02 B.C02与H20
C.NaCl与HCl D.CCl4与KCl
2、碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和S原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是 ( )
A.①③② B.②③① C.③①② D.②①③
3、下列晶体分类中正确的一组是 ( )
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 |
|
| D | Ba(OH)2 | 金刚石 | 玻璃 |
4.下列晶体中不属于原子晶体的是 ( )
A.干冰 B.金刚砂
C.金刚石 D.水晶
5.在金刚石的网状结构中,含有共价键形成的碳原子
环,其中最小的环上,碳原子数是 ( )
A.2个 B.3个 C.4个 D.6个
6,下列各物质中,按熔点由低到高排列正确的是( )
A.02、I2、Hg B.C02、KCl、Si02
C.Na、K、Rb D.SiC、NaCl、S02
7.在x mol石英晶体中,含有Si-O键数是 ( )
A.x mol B.2x mo} C.3 x mol D.4x mol
 8.固体熔化时,必须破坏非极性共价键的是 ( )
8.固体熔化时,必须破坏非极性共价键的是 ( )
A.冰 B.晶体硅 C.溴 D.二氧化硅
9、石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
A.10个 B.18个 C.24个 D.14个
10.短周期元素K、Y、Z在周期表中位置关系如图:
(1)x元素的单质分子式是_______,若x核内中子数和质子数相等,x单质的摩尔质量为_______,单质是_______晶体。
(2)自然界中存在一种含Y的天然矿物名称是:电子式为_______,属于
| X | ||
| Y | ||
| Z |
_______晶体。
(4)z单质的晶体类型属于_______,Z的氢化物和最高价氧化物的浓溶液反应的化学方程式为____________________________
11、SiO44-离子结构用周 表示,在二聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________
表示,在二聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是__________
12.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1 300℃反应获得。
(1)氮化硅晶体属于__________晶体。
(2)已知氮化硅的晶体结构中,原子间以单键相连,且N原子和N原子,Si原子和S原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式__________
(3)现用SiCl4和N2在H2,气氛保护下,加强热发生反应,可得较高纯度的氮化硅。反应的化学方程式为__________________________________________________
13、单质硼有无定形和晶体两种,参考下表数据
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点 | >3823 | 1683 | 2573 |
| 沸点 | 5100 | 2628 | 2823 |
| 硬度 | 10 | 7.0 | 9.5 |
①晶体硼的晶体类型属于____________晶体,理由是________________________。
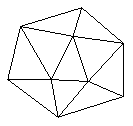 已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。通过视察图形及推算,此晶体体结构单元由
已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。通过视察图形及推算,此晶体体结构单元由
____________________个硼原子构成。其中B—B键的键角为____________。