高三化学模拟
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分,考试时间:120分钟。
可能用到的相对原子质量:H:1,C:12,O:16,S:32,Cl:35.5,Na:23,Ca:40,Cu:64。
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)阅读下列材料,回答1、2两个问题。
2002年度诺贝尔化学奖授予发明生物大分子“质谱分析法”的美国科学家约翰·分恩、日本科学家田中耕一和发明“利用核磁共振技术测定溶液中生物大分子三维结构法”的瑞士科学家库尔特·维特里希荣获。此法不仅可以准确测量生物大分子的相对分子质量,而且可以进一步揭示各种蛋白质分子的氨基酸构成和"DNA"分子内核糖核酸的构成及序列结构,这一成果有一种说法叫“看清大分子”,解决了生物界的难题。
1、人工合成的具有生物活性的结晶牛胰岛素也是大分子,这一成果曾经被作为诺贝尔化学奖提名,首次合成该物质的国家是
A. 中国 B.美国 C.英国 D.日本
2、关于这一成就的说法不正确的是
A. 这一成就是化学的手段在生物研究中发挥出的巨大作用
B.这说明不同学科之间是紧密关联的
C.“看清大分子”的实质是将生物大分子在特殊的显微镜下的放大过程
D.由此看出,科学不仅是单一学科领域的研究
3、世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列关于二氧化氯的说法正确的是
A.C1O2是强氧化剂 B.C1O2是强还原剂
C.ClO2是离子化合物 D.ClO2分子中氯为-1价
4、据2001年12月的《参考消息》报道,有科学家提出硅是”21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.自然界中存在大量单质硅
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.自然界硅的贮量丰富
5、下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是
A. 化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
6、氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸产生氮气,有关氢叠氮酸的叙述:①NaN3的水溶液呈碱性;②HN3的固体属于分子晶体;③NaN3的固体属于离子晶体;④NaN3可用于小汽车防撞保护气囊。其中正确的是
A.①②③ B.②③④ C.①③④ D.全对
7、“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出直径从几纳米至几十纳米的材料(1 nm=10-9m),若将纳米材料分散到分散剂中,所得到混合物具有的性质是
A.能全部透过半透膜 B.不能透过滤纸
C.一定是无色、透明溶液 D.具有丁达尔效应
8、下列反应,其产物的颜色按红、紫、黄、蓝色的顺序排列的是
①硝酸银溶液中滴人碘化钾溶液 ②硫酸铁溶液中滴入苯酚溶液
③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜粉末放人医用酒精中
A.③②①④ B.②③①④ C.③①②④ D.①②③④
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9、用No表示阿伏加德罗常数的值;下列说法正确的是
A.1 mol硫与足量钠完全反应转移的电子数为No
B.32g氧气和32g臭氧所含原子数均为2No
C.在常温常压下,22.4LNH3所含质子数为10No
D.在标准状况下,2.24L二氧化碳与二氧化硫混合气中所含分子数为0.1 No
10、下列离子方程式书写正确的是
A.氯化铵溶液中加人氢氧化钠稀溶液:NH+4+OH-====NH3·H2O
B.将少量的硝酸银溶液滴入氨水中:Ag++2NH3·H2O====[Ag(NH3)2]++2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D.过量的碳酸氢钠溶液与氢氧化钡溶液混合:HCO-3+Ba2++OH-====H2O+BaCO3↓
11、在含有选项的四种阴离子的溶液中,加入少量过氧化钠固体,离子浓度几乎不变的是
A.F- B.HCO3- C.CO32- D.S2-
12、在一定量的Ba(N03)2溶液中滴入0.05mol/L的稀硫酸,恰使溶液中的Ba2+沉淀完全。此时溶液的体积为100mL(忽略反应时溶液体积变化),测得溶液的pH=2,则原Ba(NO3)2溶 液中Ba2+的物质的量浓度是
A.0.01lmol/L B.0.1lmoL/L
C.0.0055mol/L D.0.055mol/L
13、按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述正
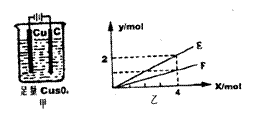 确的是
确的是
A.F表示反应生成Cu的物质的量
B.E表示反应消耗H2O的物质的量
C.E表示反应生成O2的物质的量
D.F表示反应生成H2SO4的物质的量
14、已知2H2(g)+O2(g)====2H2O(1);△H=-571.6kJ/mol
CO(g)+O2(g)====CO2(g); △H=-282.9kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为
A.2:1 B.1:2 C.1:1 D.2:3
15、已知甲醛(HCHO)分子中的4个原子共平面的。下列分子中所有原子不可能同时存在于同 一个平面上的是
A.CH2=CH—CH=CH2 B.CH≡C—COOH
C.CH3CHO
D. 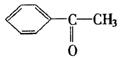
16、可逆反应2A(?)+B(?)![]() 2C(气)(正反应为吸热反应)。随温度降低,气体的平均相对分子质量有变小的趋势,则下列判断正确的是
2C(气)(正反应为吸热反应)。随温度降低,气体的平均相对分子质量有变小的趋势,则下列判断正确的是
A.A和B可能都是固体
B.A和B一定都是气体
C.若B为固体,则A一定是气体
D.A和B可能都是气体
17、根据环保要求,下列各组中的两种溶液能倒在同一废液缸中的是
A.盐酸和氢氧化钠 B.硫酸铵和氯化钡
C.硝酸亚铁和盐酸 D.亚硫酸钠和硫酸
18、L—多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
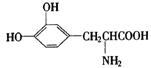 下列关于L—多巴性质的推测正确的是
下列关于L—多巴性质的推测正确的是
A.不可能形成高分子化合物
B.不易被氧化
C. 只有酸性,没有碱性
D.能与溴发生取代反应
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共20分)
19、(9分)(1)下列实验操作正确的是(选错1个扣2分,扣完为止)
A.向一支洁净的试管中加人2mL3%硝酸银溶液,再向试管中滴加氨水至产生的沉淀恰好 溶解为止,加入乙醛溶液,水浴加热,片刻后将在试管内壁形成银镜。
B.实验室制取乙烯时,必须将温度计的水银球插入反应液中。
C.取2mL4mol/LNaOH溶液于试管中,加入2mL2mol/LCuSO4溶液,再加入某种有机试 剂,加热,可根据是否产生红色沉淀判断该有机物中是否含有醛基。
D.分离苯和苯酚的混合液,可向混合物中加人适量浓溴水,过滤、分液,即可实现。
E.取20mL蒸馏水于50mL烧杯中,加热至沸,加人数滴饱和FeCl3,溶液,持续加热片刻,即可制得Fe(OH)3胶体。
F.向盛有0.1mol/L AgNO3溶液的试管中滴加0.1mol/L KI溶液,用力振荡,即可制得AgI胶体。
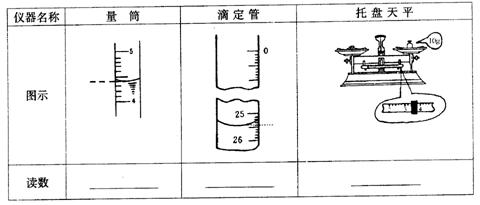
(2)化学上有许多重大发现来自于实验中的精确测量以及对实验数据的处理。根据下列计量仪器的图示,准确填写表格中的读数。(下列玻璃仪器单位均为毫升)
20.(11分)下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的简易装置(图中 必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=NaNO2+H2O。实验中所选用的试剂不超出下列范围,且不得重复使用。
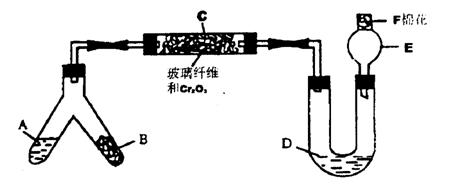
①NH4Cl和Ca(OH)2的混合物;②浓氨水;③NaOH固体;④KClO3和MnO2的混合物;
⑤6mol/LNaOH溶液;⑥0.5moL/LNaOH溶液;⑦酚酞试液;⑧碱石灰;⑨浓H2SO4;⑩CuO。
试回答下列问题:
(1)叉形管中液态物质A是(填代号) ,固体物质B是(填代号) ;
(2)C处发生反应的化学方程式是 ;
(3)混合物D是为了检验酸性物质的生成而放人的,其组成是(填代号) ,实验
过程中的现象是:
(4)E处球形玻璃管的作用是 ;
(5)F处的棉花应蘸取的物质是(填代号) ,其作用是
四、(本题包括2小题,共17分)
21.(9分)下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质
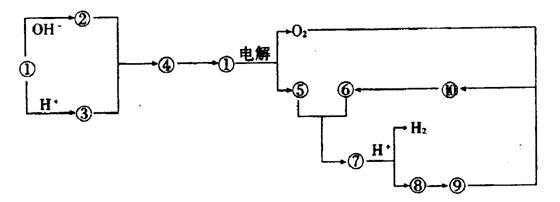
(1)①的化学式为 ,⑤和⑥反应的化学方程式为 。
(2)实验室由⑧制取⑨的离子方程式为 ,⑨转变为⑩的化学方程式为 。由⑨转变为⑩的反应现象为 。
22.(8分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其 电子层数的2倍,Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X ,Y ,Z 。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是 。
A.消去反应 B.取代反应
C.加成反应 D.聚合反应
(3)最近科学家们合成了Zn+5,电子式为![]() 则n值为
。
则n值为
。
(4)Z与X可形成多种化合物,其中ZX3的结构式为 ,Z2X4的电子式为
。(用判断出的元素符号表示)
五、(本题包括2小题,共21分)
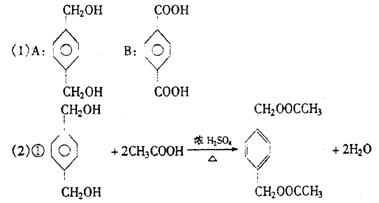
23、(12分)已经知:
有机物E和F可用作塑料增塑剂或涂料的溶剂,它们的相对分子质量相等。可以用下列方法合成。
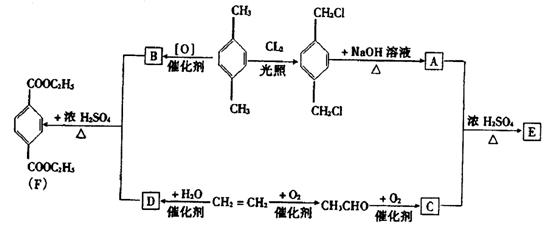
(1)写出A、B的结构简式。
 |  |
A B
(2)写出下列反应的化学方程式
①A+C——→E:
②CH2=CH2 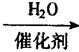 D
D
③A+B——→高分子化合物的化学方程式
。
(3)E和F的相互关系是( )
A. 同一种物质 B. 同一类物质 C. 同系物 D. 同分异构体
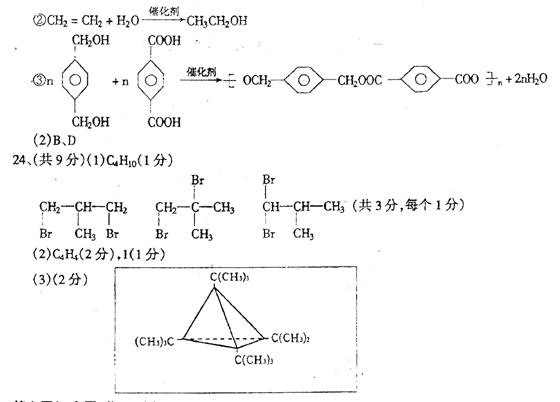
24、(共9分)科学家于1978年制得一种物质A,A可看作是烃B的所有氢原子被C的某种一价基(即失去一个氢原子后剩余的部分)取代而得。A遇溴水不褪色;A中的氢原子被一个氯 原子取代只得一种物质。一定量的C完全燃烧所得到的CO2和H2O的物质的量之比为1:1.25,C在常温下为一种气体,其二溴代物有3种。B完全燃烧生成的C02和H20的物质的量之比为2:1,B的相对分子质量大于26,小于78。试回答以下问题:
(1)C的分子式是 。写出C的三种二溴代物的结构简式。
、 、 。
(2)已知B分子不是一种平面结构,B的分子式是 ,B中的一个氢原子被氯原子取代所得产物共有 种。
(3)写出A的结构简式(需表达出分子中原子的空间位置关系):
 |
六、(本题包括2小题,共18分)
25.(8分)血液中葡萄糖含量(血糖)过高会引发糖尿病,低血糖又会导致人易发生昏厥。正常人的血糖应在3.9mmol/L~6.2mmol/L之间。某人血样经检验后得知血糖的质量分数为 0.1%。如果血液的密度按照1g/mL计,通过计算说明此人血糖含量是否异常?(1mmol/L=0.001 mol/L,葡萄糖相对分子质量为180.)
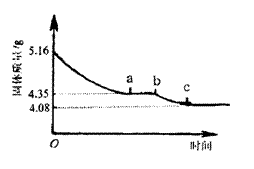
26.(10分)某化学研究性学习小组在研究某结晶水合物(MSO4·2H2O)的过程中,做了如下实 验:将含结晶水合物放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下表。
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 | 加热后 | |
| 1 | 5.16 |
|
| 2 | 5.16 | 4.68 |
| 3 | 5.16 | 4.35 |
| 4 | 5.16 | 4.35 |
| 5 | 5.16 | 4.20 |
| 6 | 5.16 | 4.17 |
| 7 | 5.16 | 4.08 |
| 8 | 5.16 | 4.08 |
(注:在上述实验温度下,MSO4不分解)
利用数据可绘制成如右图所示的图像:
(1)利用实验数据,通过计算确定M元素的相对原子质量,并写出其元素符号。
(2)通过计算解释图像中产生8b段的原因以及ab段时坩埚中固体物质的化学式。
高三化学模拟答案
第Ⅰ卷(共74分)
一、二:(共18题,共74分)
1A 2C 3A 4B 5C 6D 7D 8A 9BD 10AB 11A 12C
13B 14C 15CD 16CD 17AB 18D
第Ⅱ卷(共76分)
第三题(2小题,共20分)
19、(共9分)(1)(共6分,每个2分,写错1个倒扣2分,扣完为止)A、B、E
(2)(共3分)量筒:4.4mL 滴定管:25.40mL 托盘天平:13.4g
20、(共11分)(1)②(1分);④(1分)。
(2)4NH3+5O2![]() 4NO+6H2O;(2分,条件缺少扣1分,不配平0分)
4NO+6H2O;(2分,条件缺少扣1分,不配平0分)
(3)⑥⑦(2分,少1个扣1分,错1个0分),红色褪去(1分);
(4)作安全瓶(或防止液态物质冲出)(1分);
(5)⑤(1分),吸收氮的氧化物(2分)。
第四题(2小题,共17分)
21、(共9分)(1)Al2O3(1分),2Al+Fe2O3![]() 2Fe+Al2O3(2分)
2Fe+Al2O3(2分)
(2)Fe2++2OH===Fe(OH)2↓(2分)
4Fe(OH)2+2H2O+O2====4Fe(OH)3(2分)
白色沉淀迅速变成灰绿色,最终变为红褐色沉淀。(2分,只要有关键词即可)
22、(共8分)(1)氢 碳 氮(写元素符号也可,每个1分,共3分)
(2)C (1分) (3)1(2分)
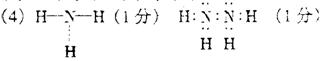
第五题(2小题,共21分)
23、(共12分,每空2分)
第六题(2小题,共18分)
25、(6分)解:
某某学生的血糖浓度为:(列式正确的给2分,结果正确给2分)
![]() =5.56×10-3mol/L,即为5.56mmol/L
=5.56×10-3mol/L,即为5.56mmol/L
该同学血糖浓度在正常人的范围内(2分)。
26、(共12分)根据表格和图中所示,堤取有用数据:
(1)MSO4·2H2O![]() MSO4+2H2O
MSO4+2H2O
M+96+56 36
5.16g 1.08g
M=40 该元素的相对原子质量为40,元素符号为Ca.
(其他合理解法也给分,如差量法、关系式法等均可,列式正确得2分,结果正确3分,写出元素符号1分)
(2)实验数据和图象ab段说明在生石膏受热分解过程中,有一固定组成的化合物存在。
CaSO4·2H2O![]() CaSO4·yH2O+(2-y)H2O
CaSO4·yH2O+(2-y)H2O
172 136+18y
5.16g
4.35g
y=![]() (列式正确给2分)
(列式正确给2分)
该化合物为2CaSO4·H2O(或CaSO4·![]() H2O)。(结果正确3分)。因为在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,因此图像中有ab段。(1分,其他合理说法也给分).
H2O)。(结果正确3分)。因为在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,因此图像中有ab段。(1分,其他合理说法也给分).
 4.89
4.89