高三化学月考试卷2
温岭二中 吴建国
一、选择题(每小题只有一个正确答案)
1、下列分子中不存在氢键的是( )
A H2O B HF C CH3OH D CH3CH3
2、用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同的数量级的是( )
A 溶液 B 悬浊液 C 胶体 D 乳浊液
3、下列各种晶体熔化只需克服分子间作用力的是( )
A SO3 B Ag C SiC D NaCl
4、下列过程共价键被破坏的是( )
A 萘升华 B 白磷溶于CS2 C HCl气体溶于水 D 蔗糖溶于水
5、下列有关晶体的叙述中,错误的是( )
A 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或Na+)
C 白磷晶体中,所有原子间都是通过共价键结合,键角为60º
D 离子晶体、原子晶体在熔化时,化学键被破坏,而分子晶体熔化时,化学键不被破坏
6、由相同条件下的三个反应:2A- + B2 = 2B- + A2 2C-+ A2 = 2A- + C2
2B- + D2 = 2D- + B2由此可以判断( )
A 氧化性 A2> B2 > C2 >D2 B 还原性 C- > A- > D- > B-
C 2A- + D2 = 2D- + A2该反应可以进行
D 2C- + B2 = 2B- + C2该反应不能进行
7、m mol FeS与n mol FeO的混合物放入c mol/L的HNO3溶液VL中完全溶解后,测得产物为Fe(NO3)3 、H2SO4 、NO 、H2O ,则参加反应的HNO3中,未被还原的HNO3的量为( )
A 63(m+n)g B 126(m+n)g C 3(m+n)mol D Vc – 3(m+n)mol
8、石墨和金刚石都是碳元素的单质,石墨在一定条件下可转化为金刚石。已知12g石墨完全转化成金刚石时,要吸收Z 0kJ的能量,下列说法正确的是( )
A 石墨不如金刚石稳定 B金刚石熔点比石墨高
C 等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
D 等质量的石墨与金刚石完全燃烧,石墨放出的能量多
9、为了使氯化亚铁和氯化铁酸性混合溶液中氯化亚铁全部变为氯化铁,可使用的试剂是( )
A 氧气 B 溴水 C 过氧化氢 D 过氧化钠
10、下列叙述中正确的是( )
A 凡是离子化合物在离子方程式中都要以离子来表示
B 离子互换反应总是向着溶液中离子浓度减小的方向进行
C 酸碱中和反应的实质是H+ 和OH- 结合生成水,故酸碱中和反应离子方程式都是
H+ + OH- = H2O
D 复分解反应必须具备离子反应生成的三个条件才能进行
11、欲配制下列各组离子的溶液,能够实现的是( )
A Ca2+ Br - HCO3- AlO2- B Fe3+ K+ SCN- SO42-
C Fe2+ NO3- HSO3- Ag+ D Na+ AlO2- K+ C6H5O-
12、乙二酸俗称草酸,具有还原性。0.1 mol/L草酸溶液20mL,恰好将4×10-3mol的VO2-还原,则在还原产物VO2n-中,n值为( )
A 5 B 4 C 3 D 2
13、如下图所示为某晶体的一个晶胞(晶胞是晶体结构中具有代表性的最小重复单元)。该晶体由A、B、C三种基本粒子组成。试根据下图判断,该晶体的化学式为( )
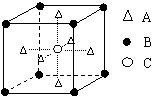 A
A6B8C
A
A6B8C
B A2B4C
C A3BC
D A3B4C
14、某电解池内盛有CuSO4溶液,插入两根电极,接通直流电源后,欲达到如下要求:①阳极质量不变,②阴极质量增加,③电解液pH减小,则应选用的电极是( )
A 阴阳两极都用铜
B 铜作阳极,铁作阴极
C 铁作阳极,铜作阴极
D 铂作阳极,铜作阴极
15、某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1。用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是( )
A 阴极自始至终只析出H2
B 阳极先析出Cl2,后析出O2
C 电解最后阶段为电解水
D 溶液pH不断增大,最后为7
16、在实验“硫酸铜晶体里结晶水含量的测定”中至少需用天平称量几次( )
A 2 B 3 C 4 D 5
17、Mg(OH)2难溶于水,但其所溶解的那一部分在溶液中完全电离。某温度时饱和Mg(OH)2溶液的pH=11,溶液密度为1.0g/cm3,设该温度时Kw=1×10-14,则该温度下Mg(OH)2的溶解度是( )
A 0.0029g B 0.029g C 0.0058g D 0.058g
18、下列说法不正确的是( )
A K2Cr2O7晶体是橙红色的
B 所有雪花的形状都是六边形的
C 常温下,所有金属都以晶体形式存在
D 有丁达尔现象的分散系不都是胶体
19、已知某盐在不同温度下的溶解度如下表:
| 温度/℃ | 1 | 10 | 20 | 30 | 40 |
| 溶解度/g | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
若质量分数为15%的该盐溶液由50℃逐渐冷却,则开始析出晶体(无水晶体)的温度范围是( )
A 0℃ -10℃ B 10℃-20℃ C 20℃-30℃ D 30℃-40℃
20、以铁为阳极、以铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到2mol Fe(OH)3
沉淀,此间共消耗的水的物质的量为( )
A 2mol B 3mol C 4mol D 5mol
21、用含锌、银杂质的粗铜做阳极,纯铜做阴极,电解某硫酸铜溶液,下列有关Cu2+的叙述中,正确的是( )
A C(Cu2+)增大 B C(Cu2+)减小 C C(Cu2+)不变 D 无法确定
二、填空题
22、将饱和氯化铁溶液滴入沸水时,液体变为 色,得到的是 ;反应的离子方程式是 ;用此分散系进行下列实验:
(1)将其装入U型管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色 ,(变深,不变,变浅)这种现象称为 。
(2)向其中逐滴加入过量的稀硫酸,发生的现象是 ,原因是 。
(3)提纯此分散系常常采用的方法叫 。
23、高氯酸铵(NH4ClO4)在强热的条件下分解,生成N2、O2、HCl 和水,反应中生成的还原产物和氧化产物的物质的量之比是 。
24、氯气在NaOH的碱性条件下可将Fe(NO3)3氧化为铁酸钠(Na2FeO4),写出这一反应的离子方程式(1) ,Na2FeO4能消毒杀菌的原因是 ,作为水处理过程中使用的一种新型净水剂的另一原因是(2) 。
25、已知C(S) + 1/2O2(g) = CO(g); ΔH = -110.5 kJ/mol
2CO(g) + O2(g) = 2CO2(g); ΔH = -566.0 kJ/mol 则C的燃烧热为 。
26、现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请回答下列问题:(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为 。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a Na2CO3溶液 b Ba(OH)2溶液,c 稀盐酸,其合理的加入顺序为 (填试剂序号)。
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生11.2L(标准状况)Cl2 ,这时溶液的pH是(设体积维持不变) 。
(4)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为 。
27、某无色溶液其中可能存在的离子如下:Na+ 、Ag+ 、Ba2+ 、Al3+ 、AlO2- 、S2- 、CO32-
SO32- 、SO42- ,现取该溶液进行有关实验,结果如下图所示
![]()
![]()
![]()
![]()
![]()
![]()
![]()

试回答下列问题
(1)沉淀甲是 ,生成沉淀甲的离子方程式是 。
(2)沉淀乙是 ,由溶液甲生成沉淀乙的离子方程式是 。
(3)沉淀丙是 ,如何用一实验来确定其成分? 。
(4)综合上述信息,可以肯定存在的离子有 ,可能存在的离子有 。
28、已知Ag(NH3)2+ + 2H+ = Ag+ + 2NH4+ 。今有一白色固体,可能是由Al2(SO4)3 、AgNO3
BaCl2 、NH4Cl、 KOH、 Na2S中的2种或3种组成,为确定该白色固体的组成,进行以下实验;第一步:取白色固体少许,加入适量的蒸馏水充分振荡得无色溶液;第二步:取第一步实验所得的无色溶液少许,滴加适量的稀硝酸有白色沉淀产生。回答下列问题:
(1)此白色固体必须含有的物质及其相对含量第一组 ,第二组 。
(2)若要确定白色固体的组成,还需要做的实验是 ,可能发生反应的关离子方程式是 。
29、据《中国环境报》报道:从一份科技攻关课题研究结果显示,我国酸雨区已占国土面积的40%。研究结果还表明,酸雨对我国浓作物、森林等影响区域很大。
如图是研究酸雨成因分析的学生实验用的“催化棒”。用两根外面套有玻璃管的粗导线穿过橡皮塞并固定粗玻璃管中,在其一端用电热丝连接起来,即制成“催化棒”。
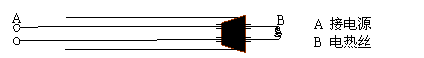 |
实验时,先接通直流电源,使电热丝红热,然后将红热的电热丝伸入装有SO2和空气的集气瓶中,瓶中立即出现 a 现象,在往其中加入盐酸酸化的BaCl2溶液,又出现 b 现象。请回答:
(1)现象:a ;b 。
(2)以上实验可得出酸雨成因的化学原理是 。
(3)目前一座中等城市每年用煤约300万吨,其含硫量如按1.0%计算,则每年排放SO2多少吨?若此二氧化硫有60%转化为H2SO4,相当于生成多少吨98%的H2SO4 ?
(4)接触法制硫酸工业中,尾气中SO2的处理方法很多。国际上最新采用“饱和亚硫酸钠溶液吸收法”进行回收,请写出有关反应的化学方程式 。
(5)取一份酸雨样品在空气中放置,每隔一段时间测定一次其pH,会发现其pH逐渐 ,
 其原因是
。
其原因是
。
三、实验题
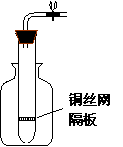
30、某学生用实验室常见的酸、碱、盐和金属为反应物,
并利用一个底部有小孔的试管和一个广口瓶组装成如图
所示的“替代简易气体发生器的装置”,该装置中装有
铜丝网隔板,利用该装置可制备哪些气体 ;
若将铜丝隔板改成铁丝网隔板,则该装置可用于制取何种
气体 ,写出反应方程式 。
31、请设计一实验证明CO32-、HCO3- 哪一个离子更容易结合H+ ?(写出实验步骤,现象及结论)
高三月考答案卷
一、填空题(每小题3分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| D | C | A | C | C | C | C | C | C | B | D |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| D | C | D | D | C | A | C | B | D | B |
|
|
|
|
|
|
|
|
|
|
|
|
(2)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)
|
|
|
(2)
(3)解: 3×104 t 5.6×104t
|
|
(5) , 。
|
|
|
,
31、实验步骤:取一支试管,加入少量的Na2CO3溶液和少量的NaHCO3溶液,然后逐滴加入稀HCl直至过量
实验现象:先无明显现象,后出现大量气泡
实验结论:CO32- 比HCO3-更容易结合H+