高三化学综合测试
一、选择题:(每题只有一个正确答案,4分×8)
1.下列关于“生活中的化学”的叙述中不正确的是
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,立即喝牛奶或生蛋清进行解毒
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.新居室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染室内空气
2.咖喱是一种烹任辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄色污渍变为红色。经水漂洗后红色又变为黄色。据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用
A 品红溶液 B 石蕊溶液
C 氯水 D KI一淀粉溶液
3.油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要的化工原料。油脂的以下性质和用途与其含有的不饱和双键(![]() )有关的是
)有关的是
A 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素
B 利用油脂在碱性条件下的水解,可以生产甘油和肥皂
C 植物油通过氢化可以制造植物奶油(人造奶油)
D 脂肪是有机体组织里储存能量的重要物质
4.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.盐酸、水煤气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.单甘油酯、混甘油酯、苛性钾、石灰石 D.胆矾、漂白粉、氯化钾、氯气
5.下列事实不能用勒夏特列原理解释的是
A.氨水应密闭保存,放置低温处
B.在FeCl2溶液中加入铁粉防止氧化变质
C.生产硝酸中使用过量空气以提高氨气的利用率
D.实验室用排饱和食盐水法收集氯气
6.最近,科学家在实验室成功地在高压下将CO2转化为类似SiO2的原子晶体结构,下列关于CO2晶体的叙述中不正确的是
A.晶体中C、O原子个数比为1:2
B.该晶体的熔、沸点高、硬度大
 C.晶体中O—C—O键角为180°
C.晶体中O—C—O键角为180°
D.晶体中C、O原子最外层都满足8电子结构
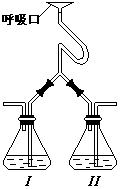
7.为验证人体呼出气体中含有的CO2不是来自空气,而是
人体代谢作用产生的。某学校学生课外活动小组设计了
如图所示装置,你认为该装置应选用的试剂是
瓶I 瓶II
A.Ca(OH)2 NaOH
B.NaOH Ca(OH)2
C.稀HCl Ca(OH)2
D.NaOH BaCl2
8.已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52 mol·L-1。47.5%的酒精溶液的物质的量浓度
A.大于8.26 mol·L-1 B.等于8.26 mol·L-1 C.小于8.26 mol·L-1 D.无法判断
二、选择题:(每题有1~2个正确答案,4分×10)
![]() 9.某工业生产中发生反应:2A(g)+B(g) 2M(g),△H<0。下列有关该工业生产的说法正确的是
9.某工业生产中发生反应:2A(g)+B(g) 2M(g),△H<0。下列有关该工业生产的说法正确的是
A、工业上在合成M时,一定采用高压条件,因为高压有利于M的生成
B、物质B价廉易得,因此工业上一般采用加入过量的B,以提高A的转化率
C、工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D、工业生产中常采用催化剂,因为使用催化剂可提高M的日产量
10.用NA表示阿伏加德罗常数,则下列说法错误的是
A.1molCH5+所含的电子数为10NA
B.1molC20H42中含有61NA个共价键
C.25℃时1mL纯水中含有10-10NA个OH-离子
D.22.4L的NH3中含有4NA个原子
11.无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
A.Cl-、Mg2+、NO![]() 、K+
B.NH
、K+
B.NH![]() 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+
D.HCO
、Na+
D.HCO![]() 、K+、NO
、K+、NO![]() 、SO
、SO![]()
12.下列离子方程式书写正确的是 A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合
Ba2++2OH-+2HCO3-====BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2O====CaSO3↓+2HClO
C.NH4HCO3溶液与足量NaOH容液混合溶液混合
NH4++HCO3-+2OH-====NH3·H2O+ CO32-+ H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2Al3++3SO2-4+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓
13.镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是KOH,放电时的电极反应式是
Cd+2OH-—2e-===Cd(OH)2, 2NiO(OH)+2H2O+2e-===2Ni(OH)2+2OH-
 下列说法不正确的是
下列说法不正确的是
A.电池的总反应式是Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的正极连接
14.下列说法正确的是
![]() A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
气体的颜色比原平衡颜色深
B.室温下,PH=7的(NH4)2SO4溶液中,C(NH4+)=C(SO42-)
C.加入浓硝酸,可加快Zn与稀盐酸反应制氢气的反应速率
D.0.1 mol·L-1醋酸溶液中加入少量醋酸钠晶体后,将使醋酸的电离程度减小,溶液的导电性减弱
15.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是
![]() A.HB-水解方程式:HB-+H2O H3O++B2-
A.HB-水解方程式:HB-+H2O H3O++B2-
B.溶液中离子浓度大小为:c (Na+)>c(HB-)>c(OH-)>c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:Na2B>NaHB
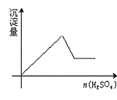 16.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
16.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
A.NaAlO2与Na2S2O3的混合溶液
B.Na2SiO3与Na2CO3的混合溶液
C.AlCl3和CuSO4的混合溶液
D.BaCl2和Ba(OH)2的混合溶液
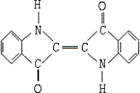 17.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示。下列关于靛蓝的叙述错误的是
17.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示。下列关于靛蓝的叙述错误的是
A.靛蓝在一定条件下能发生水解
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是不饱和的有机物
18.盐的水解程度大小可以用“水解度”来表示,关于NaA(A-表示一元酸根离子)型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2 L 0.1 mol·L-1的强碱弱酸盐NaA溶液的pH为10,则A-的水解度是
A.0.01 % B.0.1 % C.0.2 % D.1%
三、本题包括两小题,共24分
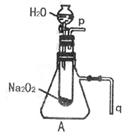 19.高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
19.高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟
水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
20.实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(![]() )和氯化铵的混合溶液加热,逸出氮气。
)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未列出):
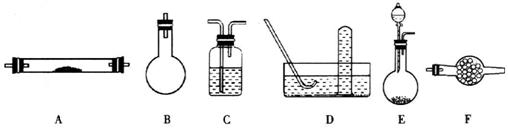
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)__________作发生装置,该反应的化学方程式______________________________。要制取并收集纯净的氮气(可含有少量的水),还要使用上述仪器中的(填仪器的编号,并按气流方向从左向右列出)___________ _________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于______________________________________________。
四、本题包括两小题,共20分
21.某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条
 件省略):
件省略):
(1)写出下列物质的化学式:
试剂x ,试剂z 。
(2)写出下列反应的离子方程式:
沉淀A+试剂y:
滤液D+过量CO2:
滤液B+试剂z(溶液):
22.(1)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-=Cu2+;还原反应为:2Fe3++2e-=2Fe2+。
①请据此将反应:Fe+4H++NO3-=Fe3++NO↑+2H2O拆写成两个“半反应式”:氧化反应为 ;还原反应为 。
②已知某一氧化还原反应为:CH4+2OH-+2O2=CO32-+3H2O;其中氧化反应的半反应可写为:CH4+10OH--8e-=CO32-+7H2O,则还原反应的半反应可写为: 。
(2)将K2MnO4溶液酸化可制得KMnO4:3MnO42-+4H+=2MnO4-+MnO2+2H2O,
但产率只有66.7%。所以制取KMnO4常用电解法,即以铁、石墨作电极电解K2MnO4溶液。此时应以 材料作阳极,该电极反应式为: 。
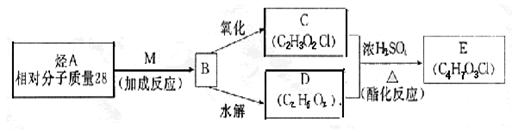
五、本题包括一小题,共14分
![]() 23.(1)烯烃、CO和H2在催化剂作用下生成醛的反应充称为烯烃的醛化反应。由乙烯制丙醛
23.(1)烯烃、CO和H2在催化剂作用下生成醛的反应充称为烯烃的醛化反应。由乙烯制丙醛
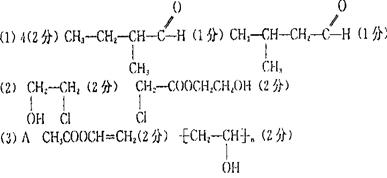
的反应为:CH2=CH2+CO+H2 CH3CH2CHO 试分析由分子式为C4H8的烯烃进行醛化反应后生成的醛可能的结构简式有 种。请写出醛(有一个支链)可能的结构简式 。
(2)已知物质M是氯气与水反应的产物之一。烃A在一定条件下有如下转化:
|
写出下列物质的结构简式:
B ;E 。
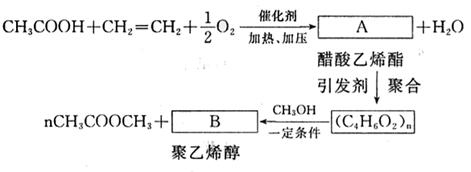
(3)纪念邮票背面刷的一层胶,主要原料是聚乙烯醇,它的生产过程简单表示如下:
|
写出下列物质的结构简式:
A ;B 。
六、本题包括两小题,共20分
24.过渡元素钴(Co)具有多种可变化合价,将11.9g CoCO3在空气中加强热,可得8.3g钴的氧化物,试通过计算写出CoCO3在空气中受热后发生反应的化学方程式。
(Co的原子量是:59)(必须写出计算过程)
25.3.2g Cu与过量硝酸(a mol·L-1,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH==NaNO3+NaNO2+H2O,
NO2+NO+2NaOH==2NaNO2+H2O。若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | B | C | B | B | C | A | A | BD |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | AD | C | CD | A | BD | A | AC | B |
19.(1)该反应是放热反应(1分);
2Na2O2+2H2O 4NaOH+O2↑(2分);Na2O2(1分);Na2O2(1分)
(2)将带火星的木条靠近导管口P处,木条复燃(3分);将导管q浸入水中,反应过程中导管口有气泡冒出(3分)
(3)MnO2(2分);气泡迅速产生,能使带火星的木条复燃(1分)(或Na2S溶液;溶液变浑浊。只要合理均可给分)
20.(1)E(2分)![]() (2分)
(2分)
E→F→A→C→D(4分,若没答出E也给4分)
(2)Cu和CuO可以循环使用,避免因使用有毒的物质![]() 而造成污染。
而造成污染。
21.(1) NH3·H2O C6H12O6(葡萄糖或CH3CHO等含醛基的有机物) (各2分)
(2) Al(OH)3+OH-=AlO2-+2H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (各2分)
22.(1)①Fe-3e-=Fe3+ NO3-+4H++3e-=NO↑+2H2O ②2O2+8e-+4H2O=8OH-
(2)石墨 MnO42--e-=MnO4-
23.
24.2CoCO3+ ![]() O2 = Co2O3 +2CO2
O2 = Co2O3 +2CO2
25.⑴利用溶液中电荷守恒:n(NO3-)×1=n(Cu2+)×2+n(H+)×1,所以:n(NO3-)=0.2 (2分);(其他合理解法也给分)
(2)设生成气体中NO2、NO的物质的量分别为X、Y
由得失电子守恒: X+3Y=0.1mol
由“N”元素守恒: X+Y=(0.03a-0.2)mol
X=(0.045a-0.35) mol ; Y=(0.15-0.015a)mol 。(共2分,只要列1或2个式子就给1分)