高三化学综合能力测试题
(一)选择题(每小题只有一个正确选项)
1.用已准确称量过的氯化钠固体配制1000mol/L的NaCl溶液0.5L,要用的仪器是 [ ]
①坩埚②分液漏斗③容量瓶④烧杯⑤胶头滴管
⑥烧瓶⑦玻璃棒⑧托盘天平⑨药匙
A.③④⑤⑦⑨
B.①②⑤⑥⑧
C.③④⑤⑦
D.③④⑤⑥
2.容量瓶上需标有①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸或碱式六项中的 [ ]
A.①③⑤
B.③⑤⑥
C.①②④
D.②④⑥
3.某学生用托盘天平称取铁粉20.6g(1g以下用游码),但砝码和铁粉的位置放反了,当天平平衡时称得铁粉的实际质量是 [ ]
A.21.2g
B.20.6g
C.19.4g
D.19.6g
4.利用电石制乙炔时最好用饱和食盐水代替水,其正确的解释是 [ ]
A.T可适当减慢生成气体的速度
B.可适当加快产生气体的速度
C.可得到更纯净的气体
D.可以充分利用电石
5.下列各组物质中,前一种与后两种物质反应后不能产生同一气体的是 [ ]
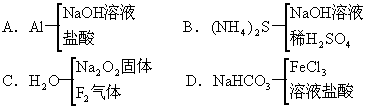
6.有两瓶pH值为2的酸溶液,一瓶是强酸、一瓶是弱酸,可用来鉴别其中的哪一瓶是弱酸的一组试剂是 [ ]
A.石蕊试液和水
B.酚酞试液和水
C.NaOH溶液
D.pH试纸和水
7.除去下列①-④中的杂质,可以使用的同一方法是 [ ]
①乙烯中含少量SO2和CO2
②乙炔中含少量的H2S
③用苯与混合酸反应制得的硝基苯
④用苯和液溴反应制得的呈红棕色的溴苯
A.萃取 B.用酸洗
C.分馏 D.用碱液洗
8.下列各组物质,可用一种试剂加以区别的是 [ ]
①4种黑色粉末:氯化亚铁、硫化亚铁、铁、氧化铜
②4种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl
③3种无色液体:CH3CH2OH、CH3CHO、CH3COOH
④3种有机溶剂:C6H6(苯)、 CCl4、 C6H12(已烯)
A.全部都可以
B.②③④
C.①②③
D.①②④
9.用含少量镁的铝片制取纯净Al(OH)3。其操作最合理的组合是 [ ]
①加盐酸溶解②加苛性钠溶解③过滤④通入过量的CO2⑤加过量的纯碱溶液
A.①⑤④③
B.②③④③
C.②③⑤③
D.①⑤③
10.已知常温下饱和CO2溶液的pH值为3.9,则可推断用盐酸滴定NaHCO3溶液测其浓度时,适宜选用的指示剂及终点的颜色变化是 [ ]
A.石蕊,由蓝变红
B.酚酞,红色褪去
C.甲基橙,由橙变黄
D.甲基橙,由黄变橙
(二)选择题(每小题有一至两个正确选项)
11.通常状况下,在实验室中用相同的气体发生装置且不需加热来制备的一组气体是 [ ]
A.Cl2、HCl、C2H4
B.CO2、H2、H2S
C.O2、NH3、CH4
D.SO2、C2H2、NO2
12.不用其他试剂,也不用加热或进行焰色反应,就能把下列各组中4种物质的浓溶液一一鉴别出来的是 [ ]
A.NaCl、AgNO3、CaCl2、Na2CO3
B.FeCl2、 Na2CO3、 NaHCO3、 Na2SO4
C.FeCl3、Na2CO3、Na2SO4、BaCl2
D.Na2SO4、BaCl2、KNO3、K2CO3
13.下列制取物质的方案能够达到目的的是 [ ]
A.用生锈的废钢铁与稀H2SO4反应制取绿矾
B.用稀HNO3与硫化亚铁反应制取H2S
C.用NaCl、MnO2和浓H2SO4共热制取Cl2
D.用Na2S溶液和AlCl3溶液混合制取Al2S3
14.下列除去括号内杂质的方法正确的是 [ ]
A.苯(苯酚):加浓溴水、振荡、分液
B.肥皂液(甘油):加热、加食盐、过滤
C.KNO3(KCl):加沸水配成饱和液、冷却结晶、重结晶
D.福尔马林(甲酸):加纯碱溶液、分液
15.下列物质的制备方法合理的是 [ ]
①C2H4:向乙醇中加少量浓H2SO4,加热至170℃左右
②FeSO4:先将Fe在氧气中燃烧,其产物再溶于稀H2SO4
③CuSO4·5H2O:先将Cu在空气中充分加热,其产物再溶于稀H2SO4
④FeCl2:过量的铁与氯气在加热下反应
A.③ B.②③
C.③④ D.全部
16.下列实验操作正确的是 [ ]
A.将浓H2SO4缓缓沿玻璃棒注入盛水的烧杯中进行稀释
B.检验溶液的pH值时,用干净的胶头滴管或玻璃棒将待测液滴在用蒸馏水润湿的pH试纸上,半分钟后与比色卡对比
C.用托盘天平称量固体NaOH时,将NaOH放在左盘洁净的滤纸上
D.过滤时,漏斗里的液体要低于滤纸的边缘
17.某溶液中含有Fe2+、Al3+、 Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取①通入H2S,②通入CO2,③加盐酸,④加NaOH溶液4个步骤,设试剂均过量,并且每次都把所生成的沉淀过滤出来。其正确的操作顺序是 [ ]
A.③①④②
B.①③④②
C.④②①③
D.④②③①
18.把锌片和铁片放在盛有稀食盐水和酚酞试液的表面皿中,装置如图4-42所示,先观察到变红的区域是 [ ]
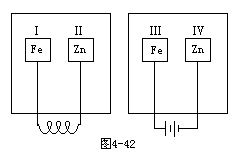
A.Ⅰ和Ⅲ
B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ
D.Ⅱ和Ⅳ
19.硬脂酸甘油酯经皂化后,反应得到硬质酸钠和甘油。欲分离出硬脂酸钠应采取的正确方法是 [ ]
①过滤 ②分液 ③蒸馏 ④盐析
A.④
B.④②
C.①③
D.④①
20.少量的下列物质需保存在水里的是 [ ]
A.钠
B.白磷
C.液溴
D.硫磺
21.下列说法正确的是 [ ]
A.漂白粉的有效成分是次氯酸钠
B.氯化氢在空气中呈现白雾状,但NH3气却不能
C.久置的碘化钾溶液也使淀粉变蓝
D.氯气在氢气中燃烧,火焰呈苍白色
22.下列各组物质中,前者为容器内壁的污物,后者为选用的洗涤剂,你认为能达到洗涤目的的是 [ ]
①水垢——稀磷酸;②酚醛树脂——乙醇;③硫磺——酒精;④盛铁盐引起的黄色沾污——稀硫酸;⑤用KMnO4制O2后的棕褐色斑迹——浓盐酸;⑥干馏煤的实验中U形管上的黑褐色油沾污——纯碱溶液;⑦久盛明矾的试剂瓶——烧碱溶液;⑧银镜——银氨溶液
A.②③④⑤⑦
B.②④⑤⑥⑧
C.②④⑤⑦
D.①②③④⑤⑥⑦
23.下列配制溶液的操作能引起浓度偏高的是 [ ]
A.用1g98%的浓硫酸加入4g水中配制1∶4硫酸溶液
B.配制一定物质的量浓度的硫酸溶液时,最后在容量瓶中加水稀释到标线,塞好塞子摇动倒转混匀后,发现液面低于标线
C.在100mL无水乙醇中,加入2g甲醛溶解配制2%的甲醛的酒精溶液
D.在80mL水中,加入18.4mol/L硫酸溶液20mL,配制3.68mol/L稀硫酸
24.图4-43是KNO3的溶解度曲线图。要使处于P点的KNO3溶液变成饱和溶液,某学生采用了如下三种方法:①恒温蒸发溶剂;②降低溶液温度;③加入一定量KNO3晶体。你认为切实可行的是 [ ]
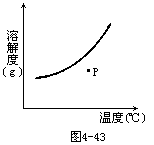
A.只有①
B.只有②
C.①和③
D.①、②和③均可
25.图4-44是一套检验气体性质的实验装置。向装置中缓慢地通入气体X,若关闭活塞K,则品红试液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红试液褪色。据此判断气体X和洗气瓶内液体Y可能是 [ ]
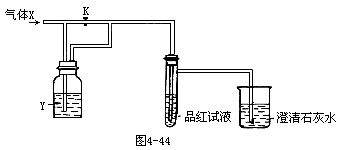
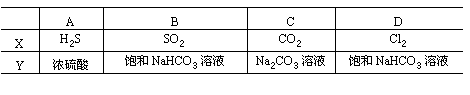
(三)选择题(每小题只有一个正确选项)
26.甲萘醌(维生素K)可通过2-甲基萘的氧化而制得
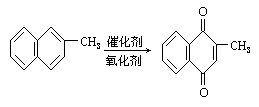
该反应中常用乙酸作催化剂,正反应是放热反应。
在某次合成中,用1.4g(0.01mol)的2-甲基萘才制得0.17g(0.00lmol)甲萘醌,已知该次合成反应的速度是很快的,试判断导致产率低的原因可能是 [ ]
A.使用了过量氧化剂
B.没有用乙酸而是用了其他催化剂
C.把反应混合物加热
D.所生成的甲萘醌是沉淀物
27.要称取4.1g纯碱,①把托盘天平调整零点后;②在左盘放4g砝码,并把游码拨到0.1g处;③然后向右盘中较缓慢地放入纯碱粉末,至天平抬起且稍向砝码端下落时;④右手轻抖药匙使药品落下至天平平衡。以上操作最主要的错误有 [ ]
A.1处
B.2处
C.3处
D.4处
28.下列描述符合实验事实的是 [ ]
①用盐析的方法可以提纯蛋白质,②用渗析的方法可以除去淀粉中的Cl-,③用加饱和Na2CO3溶液的方法可以除去乙酸乙酯中的乙酸,④将乙烷和乙烯的混合气体与H2在催化剂作用下反应可除去乙烯。
A.①②③④
B.①②③
C.只有①②
D.只有③
29.下列实验操作中,仪器需插入液面下的有 [ ]
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气的简易装置中的长颈漏斗;③分离石油时控制温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸。
A.③⑤⑥
B.②⑤
C.①②④
D.①②③④⑤⑥
30.如4-45所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻璃管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验“蒸馏水”。整个实验过程中观察到的现象是 [ ]
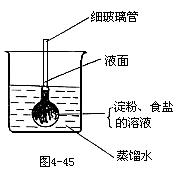
A.细玻璃管内液面下降
B.细玻璃管内液面不变
C.“蒸馏水”遇碘酒变蓝
D.“蒸馏水”遇硝酸银溶液有白色沉淀生成
(四)填空题
31.有下列实验操作供选用:①加NaOH溶液;②加盐酸;③加硝酸;④加热;⑤加硝酸银溶液;⑥加水过滤;⑦加二氧化锰;⑧露置在空气中。
(1)证明一种金属粉末是铁粉,操作的顺序是______。
(2)证明氯酸钾中含有氯元素,操作的顺序是______。
(3)证明2-碘戊烷中含有碘元素,操作的顺序是______。
32.在实验室中常用浓盐酸和二氧化锰反应来制取氯气,装置如图4-46:
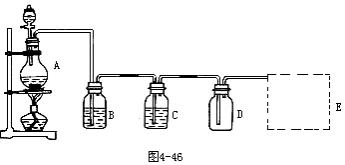
(1)写出A中反应的离子方程式:______
(2)指出B、C中物质的名称及作用
B中:______。
C中:______。
(3)D中收集到的气体是纯净的氯气吗?为什么?______。
(4)写出E中所发生反应的化学方程式,并画出实验装置图______。
(5)“加热时要缓缓加热,不要过急”。试解释这样做的原因:______。
33.某学生为测定氯化铵与硫铵混合物中氯化铵的百分含量,按下图所示实验步骤进行实验:
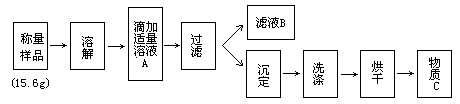
简答下列问题:
(1)溶液A溶质的分子式是______,物质C的分子式是______。
(2)若过滤用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗等,还需要的仪器或用品是______。
(3)证明A溶液滴加适量的操作方法是______。
(4)若物质C的质量为23.3g,则原混合物中NH4Cl的质量百分含量为_。
34.有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、 NO3-、SO42-、 Cl-、I-、HCO3-,取该溶液实验如下:
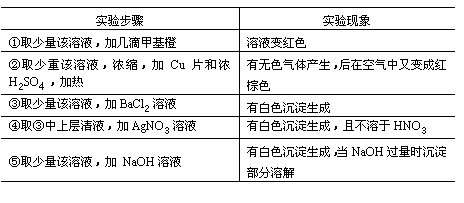
(1)溶液中肯定存在的离子是______。
(2)溶液中肯定不存在的离子是______。
(3)为进一步确定其他离子,应该补充的实验是______。
35.甲、乙两位学生用两种不同方法制取氮气,并测定氮气的分子量(用密度法)。下面是甲、乙两位学生提出的两种制备氮气的实验方案(箭头表示气体的流向)。
![]()
乙:NH4NO2→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2 ![]() N2+2H2O)
N2+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?甲______、乙______(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此一小题不用回答)______。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:______。
(4)甲、乙两位学生按正确装置制取的氮气,用密度法测出分子量(精确到0.0001),进行比较:M甲______M乙(填<或=或>)。
36.Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu和 Cu2+。现有浓H2SO4、浓HNO3、稀 H2SO4、稀 HNO3、FeCl3稀溶液及pH试纸,而没有其他试剂。简述如何用最简单的实验方法来检验CuO经过氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O?
答:________________________。
37.下图4-47是一个制取氯气并以氯气为原料进行特定反应的装置:
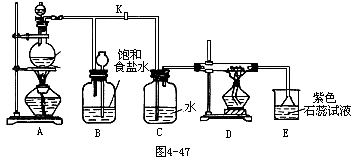
(1)A是氯气发生装置,其中的化学反应方程式为______。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:______,装置C的作用是______。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为下列选项中的______。
A.有白色沉淀生成
B.无现象
C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是______,B的作用是______。
38.为了测定某SrCl2样品的纯度,设计了如下方案:
将一定量的试样溶解(所得溶液中除Cl-外不含其他可与Ag+形成沉淀的离子),加入过量AgNO3溶液,Cl-即被全部沉淀。然后以Fe3+溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余Ag+以AgSCN沉淀的形式析出,以测定Sr-Cl2试样的纯度。试回答:
(1)指示滴定反应到终点的现象是______。
(2)实施滴定的溶液以呈______性为好,加入______试剂可以达到这一目的。
(3)在终点到达之前的滴定过程中,为防止两种沉淀吸附溶液中的Ag+,需不断剧烈摇动锥形瓶。这样的目的是______。
(4)终点到达后,则需轻轻摇动锥形瓶,以避免误差,这说明AgCl沉淀与AgSCN沉淀相比,______的溶解度更大。
(5)称取试剂0.50g,溶解后加入纯AgNO3 1.78g,以铁铵矾(含Fe3+)作催化剂,回滴剩余AgNO3时,用去0.28 mol·L-1的NH4SCN溶液25.5mL。据此,计算样品中含 SrCl2______%。
39.喷泉是自然界中的一种现象。在实验室中,利用气体和溶剂的某种性质,在一定装置中,也能模拟自然界的现象,形成美丽的喷泉。
(1)判断下列几种气体(括号内为溶剂或反应物溶液),按图4-47装置加入,能看到喷泉现象的是 [ ]
A.HCl(H2O)
B. CO2( H2O)
C.SO2(NaOH溶液)
D.NH3(汽油)
(2)(1)题中能形成喷泉的原因是______。
(3)图4-48中,烧瓶中已充满某种气体X,气体体积为1000mL(273K,101325Pa),烧杯中盛满水,直导管长L=60cm,导管进入烧杯12cm,气体的溶解度在273K时为1∶40。实验开始,胶头滴管先向烧瓶中注入1mL水,通过计算确定能否看到喷泉现象?假设压强的微小变化对气体溶解度的影响忽略不计。
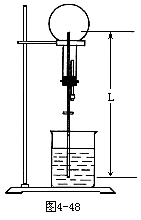
(4)某学生试图用氨水和水去做喷泉实验,结果实验失败,试分析实验失败可能的原因。
(五)计算题
40.在标准状况下100mL无色混合气体,它可能由下列气体中的部分混合而成:Cl2、NO2、H2S、CO2、CO、NH3、 N2、H2。让混合气体依次缓缓通过下列装置(假定每次反应完全):①通过浓H2SO4,溶液变浑浊,气体体积不变。②再通过饱和NaHCO3溶液,气体体积不变,但溶液质量增加0.01g。③经干燥后,又通过灼热的CuO,有红色物质生成,气体体积为55.2mL。④再通过碱石灰,将碱石灰烘干后称重,增加0.066g。⑤最后用排水取气法收集到21.6mL气体。
(1)原混合气体中有哪几种成分?
(2)100mL混合气体中各成分的体积分别是多少?
41.为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如图4-49的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气)。请填空。
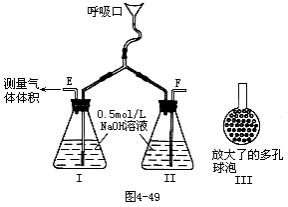
(1)图中瓶Ⅱ的作用是______。
(2)对实验装置尚有如下A、B、C、D四种建议,你认为合理的是(填代号)______。
A.在 E处增加CaCl2干燥管
B.在F处增加CaCl2干燥管
C.在E和F两处增加CaCl2干燥管
D.不必增加干燥管
(3)将插入溶液的管子下端改成具有多孔的球泡(图中的Ⅲ),有利于提高实验的准确度,其理由是______。
(4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶Ⅰ溶液增生ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式):______。
(5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会______,猛呼时会______。
参考答案
(一)1.C
2.A
3.C 提示:正确称法是“左物右码”,游码相当于加在右盘中。设所加铁粉为xg(放于右盘中了),平衡时有
![]()
4.A提示:CaC2与H2O反应过于激烈,应减速, NaCl起冲淡H2O的作用。
5.B
6.D提示:本题的依据是——弱酸溶液稀释时,由于促进电离导致[H+]变化小,pH值变化小,所测强、弱酸稀释前后pH值即可。
7.D
8.A提示:①用盐酸;②用Ba(OH)2溶液;③用Cu(OH)2悬浊液;④溴水,褪色者为C6H12,分层后红色在下层者为CCl4,在上层者为C6H6。
9.B
10.D
(二)11.B、D 提示:注意题中要求“不需加热”的条件限制。AC项中三种气体均需加热;D中三种气体制法的反应为:
SO2:Na2SO3(S)+ H2SO4(较浓)= Na2SO4+SO2↑+2H2O
C2H2:CaC2(S)+2H2O(1)→Ca(OH)2+C2H2↑
NO2:Cu(S)+4HNO3(浓)=Cu(NO3)2+2NO2↑十2H2O
12.C
13.A、C提示:Fe2O3(铁锈)+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe=3FeSO4,Fe + H2SO4=FeSO4+H2↑。结晶后得FeSO4·7H2O。
14.B、C
15.A 提示:①应加多量(3倍于乙醇)浓H2SO4,少则难起脱、吸水的作用; ②Fe与纯氧气反应生成Fe3O4,溶于稀 H2SO4后生成FeSO4和Fe2(SO4)3。④Fe(过量)+Cl2→FeCl3,与铁过量与否无关。可见①②④均不能达到目的。
16.D 提示:B错处:pH试纸不可用水润洗再用。
17.A
18.B 提示:左皿为原电池,反应为
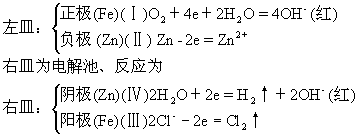
19.D提示:硬脂酸钠是固体,应用过滤分离
20.B、C
21.B、C提示:D错因为氯气不能在氢气中燃烧,氯气不具有可燃性,应为氢气在氯气中燃烧。
22.C
23.C、D
24.D
25.B、D
(三)26.A提示:过量的氧化剂会将维生素K氧化成其他物质。由于该反应不是可逆反应,尽管正反应放热,加热不会影响产量。
27.C
28.B
29.C
30.D提示:参阅教材的相应实验。
(四)31.(1)②①⑧;(2)⑦④⑥⑤③;(3)①④③⑤③
解析:判断是否某物质或某元素,可根据其对应化合物的特征来看,并且要求实验步骤简单,现象明显。如Fe→Fe(OH)3(红褐色),Cl→AgCl(不溶于稀HNO3的白色沉淀);I→AgI(不溶于稀HNO3的黄色沉淀)。所以要想办法制得Fe(OH)3;AgCl; AgI。
32.(1)MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)饱和食盐水,除去HCl;浓H2SO4,除水
(3)不是,因为排空气法收集到的气体中含少量空气
(4)Cl2+2NaOH=NaCl+NaClO+H2O:装置如图4-49所示
(5)以减少浓盐酸中HCl的挥发,减少Cl2中的杂质。
33.(1)BaCl2〔或Ba(NO3)2〕;BaSO4
(2)玻璃棒(3)取上清液加BaCl2溶液后无沉淀 (4)15.38%
34.(1)Mg2+、Al3+、NO3-、SO42-
(2)Fe2+、Ba2+、I-、HCO3-
(3)焰色反应:加AgNO3溶液和稀HNO3(原溶液中)
35.(1)能;不能(2)因为N2与Mg反应生成Mg3N2,不应灼烧镁粉(3)不能;甲方案中碱石灰除干燥空气外,还要吸收空气中的CO2,而浓H2SO4只能吸水而不能吸CO2(4)M甲>M乙提示:甲气体不纯,有分子量大的稀有气体等存在。
36.取少量红色物质放入稀H2SO4中振荡,若溶液变蓝,说明有Cu2O,否则无。
37.(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)2Cl2+C+2H2O ![]() 4HCl+CO2;提供反应物Cl2和H2O(3)HCl溶解后溶液显酸性,使石蕊试液变红,过量的Cl2与H2O反应生成的HClO有漂白性,可使红色褪色(4)B(5)长颈漏斗中液面上升;作安全装置
4HCl+CO2;提供反应物Cl2和H2O(3)HCl溶解后溶液显酸性,使石蕊试液变红,过量的Cl2与H2O反应生成的HClO有漂白性,可使红色褪色(4)B(5)长颈漏斗中液面上升;作安全装置
38.(1)溶液由无色刚好变成红色
(2)酸; HNO3(或硝酸)
(3)为了减少误差
(4)AgCl(或氯化银)
(5) 53.5%
39.(1)A、C
(2)因气体极易溶于水,少量水进入后能溶解大量气体,导致容器内气体物质减少,压强减小(由pv=nRT可知),容器外压强大于瓶内将水压入瓶中——形成喷泉。
(3)根据题意,1mLH2O最多能溶于40mL气体X,容器内压强减至:
101325×(1000-40)/1000(Pa)
内外压强差为
p(气)=101325-101325×(100-40)/1000=4053(Pa)
导致水柱高 h=60cm-12cm=48cm
p(水)=ρgh=1×9.8×480=4704(Pa)
因为p(气)<P(水),所以不能看到喷泉。
(4)制备NH3的瓶子潮湿;塞子漏气,滴入烧瓶里的水太少;导管太长等。
(五)40.(1) H2S,CO,H2,N2。
(2)H2S∶11.2mL CO∶22.4mL
H2∶44.8mL N2∶21.6mL
解析:将题设情境重整如下框图:
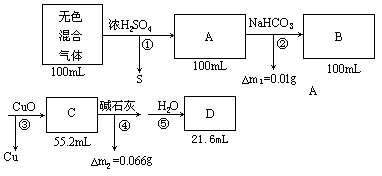
分析:①浓H2SO4浑浊Þ有S产生Þ原气体中有H2S,设为xmL
H2S+H2SO4(浓)=S↓+SO2↑+2H2O
xmL xmL
∴体积不变,VA=100mL,其中含xmL SO2
②由题VA=VB=100mL,故SO2与生成的CO2为1∶1,
SO2+NaHCO3=NaHSO3+CO2↑
xmL xmL
即B中含xmL CO2 SO2 —CO2 — Δm1
1mol 1mol 20g
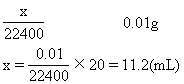
③CuO→Cu,说明B中含CO、H2或其中之一
设CO为ymL,H2为zmL
![]()
此反应无气体生成
CuO+CO ![]() Cu+CO2
Cu+CO2
ymL ymL
此反应气体体积前后不变
故z=100-55.2=44.8(mL)—H2
C中含CO2为:(y+11.2)mL
④气体C干燥之后通过碱石灰增重,只是由吸CO2引起,所以C中含CO2的质量为0.666g.
![]()
∴ y=22.4mL(即原气体中的CO)
⑤ D中的21.6mL均为N2,(因为原混合气体为无色,不可能含有NO2,Cl2)
41.(1)除去吸入空气中的CO2
(2) D
(3)可以增大气体与溶液的接触面积,使CO2被充分吸收。
![]()
(5)把瓶Ⅰ中的NaOH溶液吸入口中;把瓶Ⅱ中的NaOH溶液吹出瓶外。