高三化学综合培训试题(六)
澧县一中高三化学备课组编写孙昌银 刘镇锋
一、选择题
1,将放射性的同位素35S与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3。若将所制得的Na2S2O3酸化,又可得到含放射性硫的沉淀,而逸出的气体SO2无放射性。有关反应的化学方程式为:S + Na2SO3 == Na2S2O3, S2O3 2- + 2 H+ == S + SO2 + H2O。 这一实验表明( )
(A) 两种硫之间没有发生交换作用
(B) 在Na2S2O3内部两个硫原子等价
(C) 在Na2S2O3内部两个硫原子不等价
(D) 在合成Na2S2O3时,放射性硫作还原剂
2,单质钛的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4,③H2TiO3=TiO2+H2O,④TiO2+2C+2Cl2= TiCl4↑+2CO↑,TiCl4+2Mg=2MgCl2+Ti,下列叙述错误的是( )
(A) 反应①是非氧化还原反应 (B) 反应②是水解反应
(C) 反应④中TiO2是氧化剂 (D) 反应⑤表现了金属镁还原性比金属钛强
3,在一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·[c(OH-)]2=Ksp,其中Ksp称为Mg(OH)2的溶度积。试推断氢氧化镁在下列物质中的溶解度由小到大的顺序是( )
① 0.1mol/L MgCl2溶液 ② 0.lmol/L NH4Cl溶液
③ 0.1mol/L KCl溶液 ④ 0.1mol/L KOH溶液
(A)①④③② (B)②①③④ (C)③①④② (D)④①③②
4,现有铷和锌组成的合金共10g,与水作用有1.12L氢气(标准状况下)放出,则合金中锌的质量分数为(提示:锌同铝一样能溶于强碱)( )
(A) 57.25% (B) 42.75% (C) 28.63% (D) ABC都不正确
5,化学工作者把烷烃、烯烃、炔烃… …的通式转化成键数的通式,给研究有机物分子键能大小的规律带来了很大的方便。设键数为I,则烷烃中碳原子数与键数的关系的通式为CnI3n+1 ,烯烃、环烷烃中碳原子数与键数的关系的通式为CnI3n 。则苯的同系物中,碳原子数与键数关系的通式为( )
(A) CnI3n-1 (B) CnI3n-2 (C) CnI3n-3 (D) CnI3n-4
6,在加有稀H2SO4的H2O2溶液中,加入乙醚后,再加入少量K2Cr2O7溶液并振荡,在乙醚层中生成深蓝色的2CrO5•(C2H5)2O,其主要反应的离子方程式为:
![]()
已知CrO5的结构为: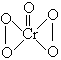
下列叙述正确的是( )
(A) 乙醚作萃取剂 (B) 此反应是氧化还原反应
(C) 可用乙醇代替乙醚 (D) 此反应中H2O2被氧化
二、填空题
7,已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1) 请写出并配平上述反应的化学方程式____________________________________。
(2) 此反应的还原剂是______________,它的氧化产物是_________________。
(3) 此反应的离子反应方程式可表示为:_______________________________。
(4) 若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
8,一个完整的氧化还原反应方程式可以拆写为两个“半反应”:一个是“氧化反应”式,一个是“还原反应”式,如:2Fe3++Cu==2Fe2++Cu2+的拆开结果是:氧化反应为:Cu-2e—==Cu2+ 还原反应为:2Fe3++2e-==2Fe2+
(1)请据此将反应:3NO2+H2O==2H++2NO![]() +NO拆写成两个“半反应式”
+NO拆写成两个“半反应式”
_____________________________________;_____________________________________。
(2)已知某一反应的半反应式为O2+2H2O+4e—==4OH-;CH4+10OH--8e-==CO![]() +7H2O,则总反应式为___________________________________________________________。
+7H2O,则总反应式为___________________________________________________________。
9,美国化学家路易斯提出的酸碱电子理论认为:凡能接受电子对的物质称为酸(如H+),能接受几对电子对则称几元酸,凡能给出电子对的物质称为碱(如NH3)。N2H4称为联氨,由NH3中的一个氢原子被一个NH2取代而成,它是一种重要的还原剂,常与NO2、F2一起作火箭燃料。
( l )N2H4是____元____(填“酸”或“碱”)。
( 2 )写出N2H4与 NO2、F2作火箭推动剂的反应方程式:
_____________________________________________________________;
_____________________________________________________________。
10,铅蓄电池放电时起原电池的作用,充电时起电解池的作用,铅蓄电池在放电和充电时发生的化学反应可用下式表示:
(1)蓄电池使用日久后正负极标志模糊,现根据下列两种条件,如何来判断正负极:
①氯化铜溶液,两根带有铜导线的碳棒______________________________________。
②硫酸铜溶液,两根相同的铜导线__________________________________________。
(2)假如采用第②种方法进行实验,实验前后分别精确称重硫酸铜溶液和两根铜导线的总质量,假如不考虑实验误差,前者质量将_____(填“增大”、“减小”或“不变”);后者将______填(“增加”、“减少”或“不变”)。假使两根铜导线质量之差为0.32g,则铅蓄电池内部要消耗H2SO4_______mol。
(3)铅蓄电池的电压正常情况下保持2.0V,电压下降到约1.85V时需要重新充电,铅蓄电池充电时,阴极反应式为__________________________。
三、推断题
11,水解反应是广泛存在的一类反应,盐的水解即为一例,越弱越水解是盐水解的重要规律,如NaCl不水解、MgCl2水解,而同浓度的AlCl3水解程度比MgCl2高,从同周期中元素金属性递变规律看H4SiO4的碱性更弱,因而SiCl4水解更完全
Mg3N及CaC2与水反应也可看做水解,注意以下规律:
![]()
![]()
(1)写出下列化学方程式
①SiCl4水解:________________________________________________________________。
②PCl5水解:_________________________________________________________________。
(2)写出下列化学方程式:
①Ca3P2与水反应:____________________________________________________________;
②Mg3C2与水反应:___________________________________________________________。
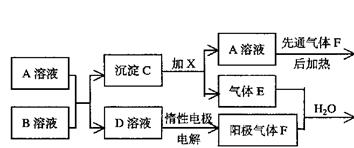
|
|
(1)请写出下列物质的化学式:C ,H: 。
(2)E与F等体积混合溶于水生成X+Y的离子方程式为 ,
电解D溶液的离子方程式为 。
四、有机试题
13,有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃。下列椭圆烯也属于稠环芳香烃。
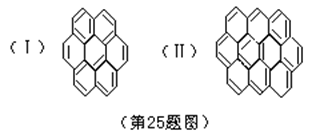
据此回答:
(1) 已知椭圆烯(Ⅰ)的分子式为C24H12,则椭圆烯(Ⅱ)的分子式为 _______________。
(2) 上述椭圆烯的一氯取代物各有几种同分异构体?
(Ⅰ)有_____种,(Ⅱ)有____种。
(3) 假如上述椭圆烯可以和氢气在一定条件下发生加成反应生成饱和脂环烃,则加氢后的生成物分子中所有的碳原子是否仍在同一平面内?为什么?_____________________________________________________________。
14,有机物A和B无论以何种比例混合,其组成的混合物中所含原子的核外电子总数均不变。
(1)若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合上述要求的有机物的分子式。
①相对分子质量之差为2:A B
②相对分子质量相等: A B
(2)若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物。则A分子式为_______,B的分子式为_______,符合B分子式的同分异构体有_______种。
15,从某些方面看,氨和水相当。试回答:
(1)氮可形成多种离子,其中N2H5+ 、N2H62+是由中性分子结合质子形成的(类似NH4+)。因此有类似于NH4+的性质,试写出N2H62+在强碱性溶液中反应的离子方程式 。
(2)若液氨相当于地球上的水以满足木星上生物生活的需要,假若那里的生命分子也是以碳链为骨架的话,那么木星上生物体内与地球上生物中葡萄糖的分子结构相当的化合物是 。(写结构简式)。
(3)化学家洛夫特菲尔在20世纪50年代发现α-卤代酮类在碱性催化剂存在时能发生重排反应生成羧基,如:
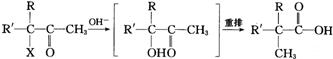
根据上述反应通过合适的步骤可以实现下列转化:
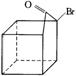 →
→
![]()
A B(立方烷)
①A式的分子式为
②要从A式转化为B式,除先进行上述重排反应后加碱中和之外,还需要进行第三步反应,第三步反应的化学方程式为(用有机结构简式表示)
③对于立方烷B,其一氯代物有 种同分异构体,二氯代物有 种同分异构体,三氯代物有 种同分异构体。
④20世纪80年代中期,美国华裔科学家合成了立方烷的四硝基衍生物动它是一种烈性炸药,四硝基衍生物可有多种同分异构体,但又是一种最稳定的,它就是C,画出C的结构简式: ;C爆炸后能生成两种稳定的单质和两种氧化物,则C爆炸的化学反应方程式是 。
(4)有A、B、C、D、E五种气体,C对空气的相对密度为2.45,在相同温度和压力下,B、D、E的密度之比为4︰2︰1,这五种气体均为常见气体,各气体两两混合时出现如下情况:
| 气体 | A+B | A+E | C+E | D+E | B+C |
| 反应情况 | 不用光照能反应 | 不反应 | 漫射光下反应 | 点燃反应 | 有水存在时易反应 |
据此可以推知:(填化学式)
A ,B ,C ,D ,E 。
五、简答题
16,在KI和H2SO4溶液中加入H2O2,放出大量不溶于水的无色气体(气泡从溶液内部放出),同时溶液呈紫红色,且可使淀粉变蓝,写出化学方程式。
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
17,H2燃烧时除了生成水以外,还可生成少量的H2O2,但一般条件下很得到H2O2。如果将H2燃烧时产生的火焰用冰块冷却,就可检验出有极少量的H2O2生成。实验前,用两只蒸发皿盛好冰(用蒸馏水冷凝而成),做对比实验如下:
I、一只蒸发皿放在石棉网上加热,使冰块慢慢熔化成液体,再加入0.1mol/LKI-淀粉溶液,不显蓝色。
II、另一只蒸发皿用调节好的氢气火焰对着冰块加热,熔化成液体后,再加入0.1mol/LKI-淀粉溶液,立即成蓝色。
试回答:
(1)为什么一般条件下得不到H2O2?____________________________________________。
(2)为什么要做对比实验I?___________________________________________________。
(3)为了增强实验效果,且能迅速检出反应过程中生成的H2O2,在不另加任何试剂和用品的情况下,你认为如何改进为好?_____________________________________________。
(4)可否将实验II中的淀粉换成酚酞试液?为什么?___________________________________________________________________________________________________。
六、化学实验题
18,实验室用干燥、纯净的![]() 与熔融的Sn反应制
与熔融的Sn反应制![]() 同时放出大量的热。已知
同时放出大量的热。已知![]() 常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,产生白色烟雾。Sn的熔点:231℃,下图是制取
常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,产生白色烟雾。Sn的熔点:231℃,下图是制取![]() 的实验装置。
的实验装置。
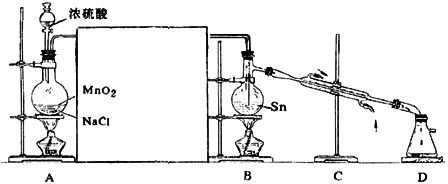
试回答以下问题:
(1)装置A中反应的化学方程式 。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。
(3)进行实验时,应先点燃(填写字母,下同)
处的酒精灯,当反应生成![]() 时,应熄灭
处的酒精灯,理由是
时,应熄灭
处的酒精灯,理由是
。
(4)装置C的作用是 。
(5)进行此实验,D装置后应当连接的装置及作用是(按从左到右的顺序写出仪器名称及其中的药品) 。
七、分析与计算题
19,已知在酸性条件下有如下关系:①KBrO3能把KI氧化成I2或KIO3,KBrO3本身被还原为Br2;②Br2能氧化I-为I2;③KIO3能氧化I-为I2;④KIO3能氧化Br-为Br2。在③④反应中KIO3被还原为I2。试回答:
(1) KBrO3、KIO3、Br2、I2氧化性由弱到强的顺序。
(2) 现取6 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.4 mol·L-1 KI溶液在稀H2SO4中混合,生成的氧化产物是什么?物质的量之比为多少?
化学综合培训练习试题(六)答案
一、选择题
1,AC;2,C;3,D;4,A;5,C;C;6,A。
二、填空题
7,(1)2MnSO4+5K2S2O8+8H2O==2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4
(3)2Mn2++5S2O82-+8H2O==2MnO4-+10SO42-+16H+
(4)Cl2
8,(1)氧化反应:2H2O+2NO2-2e-=2NO3-+4H+;还原反应:2H++NO2+2e-=NO+H2O
(2)CH4+2O2+2OH-== CO![]() +3 H2O
+3 H2O
9,(1)二 碱
(2)2N2H4+2 NO2==3 N2+ 4H2O;N2H4+2F2 == N2+ 4HF
10,(1)①电解氯化铜溶液,有气体放出的一极是阳极,对应蓄电池电极为正极。
②析出单质铜的一极为阴极,对应蓄电池电极为负极
(2)不变 不变 0.005
(3)阴极:PbSO4+2e-==Pb+SO42-
三、推断题
11,(1)①SiCl4+4H2O=H4SiO4+4HCl ②PCl5+4H2O=H3PO4+5HCl
(2)①Ca3P2+6H2O=3Ca(OH)2+2PH3↑ ②Mg3C2+6H2O=3Mg(OH)2+C2H6↑
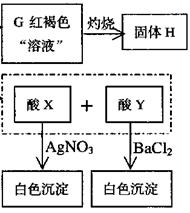
12,(1)FeSO3 Fe2O3
(2)SO2+Cl2+2 H2O ==2HCl+H2SO4;2Cl-+2H2O==2OH-+H2 + Cl2
四、有机化学试题
13,(1)C32H14(2)1,4
(3)不在同一平面内,因为饱和碳的四根共价键指向四面体的四个顶点。
14,(1)①C4H8;C3H6O ②
(2)
15,(1)N2H62++2 OH-== N2H4+2H2O
(2)
(3)①C9H7OBr
②![]() + NaOH===
+ NaOH===![]() +Na2CO3
+Na2CO3
③1,3,3
④![]() C8H4N4O4==2N2+2C+2H2O+6CO
C8H4N4O4==2N2+2C+2H2O+6CO
(4)
五、简答题
16,【分析】:这是一道颇为简单但却很容易出错的化学题,错误的原因大多是把实验现象看成只是一个反应的现象,其实,实验现象往往是若干个反应共同体现出来的,该题就是如此.有的同学认为产物中有I2 和O2 ,这没有错,但如果认为这两种物质均是由一个反应得到的话,这就错了,因为在这个反应中,这两种物质均是氧化产物,哪么还原剂是什么呢?如果还原剂是H2SO4 ,则应该有SO2生成,与题意不符,而且稀H2SO4 也没有这么强的氧化性.
H2O2 +2KI+H2SO4 =I2 +K2SO4 +2H2O
2H2O2 =2H2O+O2 ↑
17,【答:![]() 不稳定,遇热易分解】
不稳定,遇热易分解】
【答:排除冰块熔化后所得的液体也能使KI-淀粉溶液变蓝的可能】
【答:在蒸发皿中先加入KI-淀粉溶液,用氢氧焰直接对着冰块加热】
【答:不可以,因为在中性环境中,![]() 不可能生成
不可能生成![]() 】
】
六、化学实验题
18,(1)(3分)![]()
|
画对装置 2分
标对药品 2分
(饱和食盐水)(浓硫酸)
(只要合理,其它装置也可)
(3)(每空2分,共6分)B、B 、依靠反应热维持Sn的熔化。
(4)(2分)使![]() 蒸气冷凝
蒸气冷凝
(5)(共6分)连接干燥管,装有碱石灰,防止水蒸气进入锥形瓶使![]() 发生水解(3分)。连接
发生水解(3分)。连接![]() 的尾气吸收装置,装有NaOH溶液,吸收
的尾气吸收装置,装有NaOH溶液,吸收![]() (3分);(或连接干燥管,装有碱石灰,防止空气中水蒸气进入锥形瓶,使
(3分);(或连接干燥管,装有碱石灰,防止空气中水蒸气进入锥形瓶,使![]() 发生水解,吸收
发生水解,吸收![]() ,保护环境)
,保护环境)
七、分析与计算题
19,(1) I2 <Br2 <KIO3<KBrO3;
(2) KIO3、I2 n(KIO3): n(I2) ==4:3