高三化学综合训练二
本试卷分第1卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试用时90分钟。
第Ⅰ卷(选择题共74分)
可能用到的原子量: H—1 O—16 C—12 S—32
Na—23 K—39 Ag—108 Cl—35.5
一.选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性;②使用时加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。据此可推测其有效
成分可能是 ( )
A.Cl2 B.SO2 C.NaClO D.KMnO4
2.氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是 ( )
A. H2 B.HF C.O2 D.OF2
3.硫代硫酸钠是分析化学中常用试剂,已知硫代硫酸钠有下列性质:Na2S2O3+CO2+H2O=NaHCO3+NaHSO3+S↓,2Na2S2O3+O2=2Na2SO4+2S↓,Na2S2O3![]() Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( )
Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( )
A.硫酸 B.亚硫酸钠 C.硫 D.碘化汞(HgI2)
4.下列热化学方程式中的△H能表示可燃物的燃烧热的是 ( )
A.H2(g)+ Cl2(g)= 2HCl(g); △H= —184.6kJ/mol
B.CH4(g)+2O2(g)= CO2(g)+2H2O(g); △H= —802.3 kJ/mol
C.CO(g)+1/2O2(g)= CO2(g); △H= —283 kJ/mol
D.2H2(g)+ O2(g)= 2H2O(l); △H= —571.6 kJ/mol
5.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色会逐渐褪色;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.镁粉同时与溴水中的溴和酸反应 D.镁粉在水的催化下与溴发生反应
1999年诺贝尔化学奖授予了具有埃及和美国双重国籍的科学家艾哈迈德.泽维尔,以表彰他使“运用激光技术观察化学反应时分子中原子的运动”成为可能。请根据题示信息完成7-8题:
6.泽维尔研究了氰化碘的分解反应2ICN=I2+(CN)2,他发现这个反应是在200飞秒内完成的(飞秒:时间单位,1飞秒=10-15秒)。已知(CN)2的性质和卤素相似,则下列有关ICN的叙述正确的是 ( )
A.ICN的晶体是离子晶体 B.ICN是共价化合物
C.ICN不能与NaOH溶液反应 D.ICN在常温下不可能是固体
7.泽维尔还用激光技术研究了碘化钠的分解:2NaI=2Na+I2,他发现当对碘化钠晶体施以能量脉冲,当Na和I两核距离10~15Å(1 Å =10-10m)呈离子键;两核靠近约2.8 Å时呈共价键。由此可见 ( )
A.NaI 的晶体是离子晶体和原子晶体的化合物
B.Na和I之间既有离子键又有共价键
C.离子键和共价键之间没有明确的界限
D.NaI的熔点比较低
8.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为 ( )
A 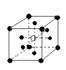 B
B 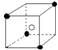 C
C 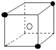 D
D 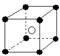
二.选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
9.设NA表示阿伏加德罗常数,下列说法中不正确的是 ( )
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,如还原产物为NO,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.常温常压下,NA个臭氧分子的体积大于22.4L
D.1.8gH2O分子中含有的电子总数为NA
10.在一恒温恒容的密闭容器内,放入3.0mol A、4.0mol B,发生如下反应:
3A(g)+4B(g)![]() 2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是
( )
2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是
( )
A.3 B.4 C.6 D.7
11.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A.A、B、E一定在不同周期 B.C的最高价氧化物的水化物可能显碱性
C.A、D可能在同一主族 D.C和D的单质可能化合形成离子化合物
12.某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
A 均减半 B 均加倍 C 均增加1mol D 均减少1mol
13.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中以下各离子浓度关系正确的是 ( )
A.C(NO3 -)>C(OH-)>C(NH4+)>C(Ba2+) B.C(NO3-)>C(Ba2+ )>C(OH-)>C(NH4+)
C.[Ba2+]+[ NH4+]+[H+]=[NO3- ]+[OH—] D.2[Ba2+]+[ NH4+]+[H+]=[NO3 -]+[OH-]
14.下列离子方程式书写正确的是 ( )
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:3Ba2++6OH-+2Al3++3 SO42-=3BaSO4↓+2Al(OH)3↓
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
D.漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
15.用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越大,它的电导越小)。如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围的H2S含量,但电导变化不大;若用浓溴水吸收,仅限于测定低浓度范围内H2S的含量,但有很高的灵敏度。现要兼顾吸收容量与灵敏度的情况下测定空气中氯气的含量,则应选用下列吸收剂中的 ( )
A.Na2SO3溶液 B.HI溶液 C.NaOH溶液 D.H2O溶液
16. 下列除去杂质的方法正确的是 ( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | I2 | / | 加热 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
17.下列各组离子能在指定溶液中,大量共存的是 ( )
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使PH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O3④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
18.将0.2mol KMnO4在一定温度下加热后生成a molO2;将剩余固体与过量浓盐酸混合加热又生成b molCl2,此时锰元素全部以Mn2+形式存在。若a+b=m,则m的值可能为 ( )
A.0.35 B.0.45 C.0.55 D.0.60
第Ⅱ卷(非选择题共76分)
三.(本题包括1小题,共14分)
19.(14分)为了测定某不溶于水的混合气体的平均相对分子质量(比空气重),设计了下列实验:①取一配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1。
②往锥形瓶中通入干燥的样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到m2。
③往锥形瓶内加满水,塞好瓶塞,得到质量m3。
已知实验时温度为T(K),压强为P(kPa),水的密度为ρ水(g/L),空气的平均相对分子质量为29.0,空气密度为ρ空气(g/L),回答下列问题:
(1)本实验的理论依据是:
____________________________________________________________________。
(2)步骤②中重复操作至质量相同的原因___________________________。
(3)如何做到每次测量都是在相同体积下进行的?___________________
________________________________________________________________。
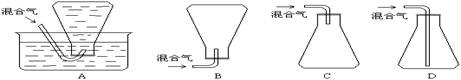 (4)本样品收集时,可选用的方法是____________。
(4)本样品收集时,可选用的方法是____________。
(5)锥形瓶内空气的质量(m空气)是______________________(列出计算式)。
(6)瓶中样品的质量(m样品)是______________________。
(7)该混合气的平均相对分子质量是:_____________________________(列出计算式)。
 四、(本题包括2小题,共30分)
四、(本题包括2小题,共30分)
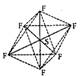
20.(14分)(1)SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为________________________种。
(2).一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
①请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
②已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。则总方程式为___________________________________________________________。
(3).一定量的液态化合物XY2,在一定量O2中恰好完全燃烧,反应方程式:XY2(l)+ 3O2(g)== XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积为 672mL,密度是2.56 g•L-1,则:
①反应前的O2的体积是(标况) ;
②化合物XY2的相对分子质量是 ;
③若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为 _、______。
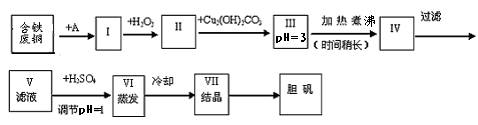
21.(16分)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料。现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程:
 PH值控制可参考下列数据
PH值控制可参考下列数据
| 物 质 | 开始测定时的PH值 | 完全测定时的PH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1) A物质可选用___________填字母。
(a)稀H2SO4 (b) 浓H2SO4 (c)浓FeCl3溶液 (d)浓HNO3
(2) I中加H2O2的目的___________________。
(3) II中加Cu2(OH)2CO3的目的是___________________________其优点是____________。
(4) III加热煮沸时发生的化学反应的离子方程式为__________________。
(5) V中加H2SO4调节PH=1是为了________________________________。
(6) 某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是__________________________________。若你是该工程师,将对所加的A物质作何改进?请提出建议_____________________________________。
五、(本题包括2小题,共22分)
22.(7分)由磷酸形成的磷脂及其化合物(如酶)是细胞的重要组成部分,它们对调节生命活动起了积极作用。假如缺少了磷,氮就是再多也不会被植物吸收。磷酸吡醛素(结构式为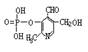 )能有效地促进植物对氮肥的吸收。 试回答:
)能有效地促进植物对氮肥的吸收。 试回答:
⑴磷酸吡醛素的分子式是 。此物质具有的性质是(填序号) 。
A.能与金属钠反应 B能发生银镜反应
C.能与FeCl3溶液反应 D能使石蕊试液变红
⑵写出磷酸吡醛素与足量氢氧化钠溶液反应的化式:
。
23.(15分)A是一种可溶于水的有机物。.从A出发,可发生图示的一系列反应而生成各种不同的有机化合物B、C、D、E、F、G、H。试写出:
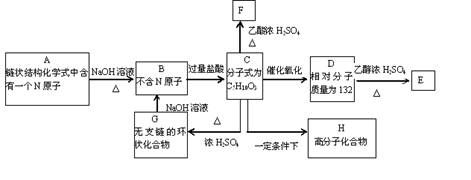
(1)化合物的结构简式:A____________ D___________ E___________。
(2)化学方程式
C→F__________________________________________。
C→H__________________________________________。
G→B___________________________________________。
六、计算题(10分)
24.现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后,全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为_________。(写出所有可能情况)
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示)______________。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况共产生672 mL气体。求a、b的值。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| C | D | D | C | D | B | C | B | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | B | C | BD | A | C | A | C | B |
19、(1)根据阿伏加德罗定律,同温、同压下,两种同体积的不同气体的质量之比等于它们的相对分子质量之比。
(2)为了保证瓶内的空气已完全被排出,并充满了样品气。
(3)第一次称量之前,锥形瓶塞紧胶塞后,在瓶口处的胶塞上做一记号,以后每次测量,胶塞塞入瓶口的位置都以此为准。(4)D
(5)(m3-m1)×ρ空气/ρ水
(6)m2-m1+m空气(或(m2-m1)+ m3-m1)×ρ空气/ρ水)
(7)29.0×m样品/m空气(或29.0×(m2-m1)/m空气+29.0 ;[(m2-m1)ρ水+(m3-m2)ρ空气]×29.0/(m3-m1)ρ空气≈29.0×(m2-m1)×ρ水)/[(m3-m1)×ρ空气]+29.0)
20、(1)10
(2) ①2NO2—2e-+H2O=4H++2NO3—
2NO2+2e-+2H+=NO+H2O
②CH4+2O2+2OH—=CO32—+3H2O
(3)①672ml ②76 ③C S
21、(1)b
(2)氧化溶液中可能残留的Fe2+
(3)调节溶液的PH值,以除去Fe3+不引入新的杂质离子
|
![]()
![]() (4)Fe3++3H2O Fe(OH)3↓+3H+
(4)Fe3++3H2O Fe(OH)3↓+3H+
(5)防止Cu2+ 水解
(6)会产生SO2污染空气。先将废铜在O2中灼烧,然后再加稀H2SO4或在O2存在条件下将废铜与稀H2SO4在加热情况下反应
22、(1)C8H10O6NP ABD
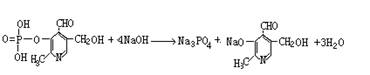 (2)
(2)
23.(1)A ![]()
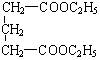
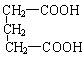 D
E
D
E
(2)
![]()
![]()
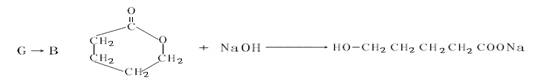
24、.(1)Fe2+或Fe2+ Cu2+ ;
(2)3Cu+8HNO3
3Cu(NO3)2+2NO↑+4H2O
ax ![]()
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
a(1-x) ![]()
故总耗HNO3量
n(HNO3)= ![]() +
+![]() =
=![]()
所以![]() <b≤
<b≤![]()
(3)根据电子守恒:0.5a×2+0.25a×3+0.25a×2=![]() ×3a=0.04 mol
×3a=0.04 mol
又知:3Cu——8HNO3 3Fe——8HNO3
0.02 mol ![]() mol 0.01 mol
mol 0.01 mol ![]() mol
mol
Fe——4HNO3(生成Fe3+)
0.01 mol 0.04 mol
b=![]() mol+0.04 mol+
mol+0.04 mol+![]() mol=0.12 mol
mol=0.12 mol