高三化学总复习试题 (1)
第I卷
一、 选择题(本题包括18小题,每小题只有一个选项符合题意。)
1.意大利科学家使用普通氧分子和特殊的氧离子作用,制造出新型的氧分子O4,它的结构很复杂。下列有关O4的说法不正确的是 ( )
A、O4与O2、O3都是氧的同素异形体 B、合成O4的反应可看作核聚变反应
C、O4分子存在非极性共价键 D、O4的密度比普通氧分子大
2.下列有机物中,既显酸性,又能发生酯化反应和消去反应的是( )
A、CH3—![]() —CH2OH B、HO—CO—CH(OH)—COOH
—CH2OH B、HO—CO—CH(OH)—COOH
C、CH3—CH=CH—COOH D、CH3—CH2—C(OH)H—COOH
3.当不慎有大量氯气逸出到周围空间时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子,该物质最适宜采用的是 ( )
A.NaOH B.NaCl C.KBr D.Na2CO3
4.氯胺H2NCl是常用的消毒杀菌剂,主要因为它能水解产生具有显著氧化性的物质,其水解的两种产物应是 ①NH4Cl②HCl③NH4ClO④NH3⑤HClO中的 ( )
A.①② B.②③ C.④⑤ D.③④
5.1 mol某气态烃能和2 mol HCl加成,其加成产物又可被6molCl2完全取代,该烃可能为( )
A.丙炔 B.丁炔 C.乙炔 D.1,3一丁二烯
6.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气由放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中 ( )
A.②③①④ B.③②①④ C.③①②④ D.①②③④
7.CaC2和 MgC2都是离子化合物,下列叙述中正确的是 ( )
A.MgC2和 CaC2都能跟水反应生成乙炔
B.C22-的电子式为[C:: C]2-
C.CaC2在水中以 Ca2+和 C22一形式存在
D. MgC2的熔点低,可能在 100℃以下
8.硼有两种天然同位素510B和511B,硼元素的相对原子质量为10.80,则硼元素中510B质量分数约为 ( )
A.20% B.80% C.18.5% D.21.5%
9.下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl5
10. 23.24毫升浓度为0.05摩/升的Na2SO3溶液,恰好与20毫升浓度为0.02摩/升的K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
11.能说明BF3分子的4个原子在同一平面中的理由是 ( )
A.B-F键为非极性键 B. 任意两个B—F键之间的键角为120”
C.三个B-F键的键能相同 D. 三个B-F键的键长相等
12.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好,室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是( ) A.氢氟酸的酸性比其它酸强 B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强 D.钛离子易与氟离子形成可溶性难电离物质 13.已知甲、乙溶质质量分数与密度的关系如下表:
| 溶质质量分数 | 甲溶液密度(g/cm3) | 乙溶液密度(g/cm3) |
| 1% | 0.95 | 1.02 |
| 5% | 0.92 | 1.04 |
| 10% | 0.90 | 1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
14.水的电离过程为H2O![]() H++OH-,在不同温度下其离子积常数为:
H++OH-,在不同温度下其离子积常数为:
(25℃) KW =1.0×10-14,(35℃) KW =2.1×10-14。则下列叙述正确的是 ( )
A. c(H+)随着温度升高而降低 B在35℃时,c(H+)>c(OH-)
C 水的电离程度(25℃)>(35℃)D 水的电离是吸热的
15.有机物分子中原子间(或原子团间)的相互影响会导致物质化学性质的不同。下列各项事实不能说明上述观点的是:
A. 甲苯能使酸性高锰酸钾溶液褪色,而苯不能
B. 乙烯能发生加成反应而乙烷不能
C. 苯酚能和氢氧化钠溶液反应而乙醇不能
D丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更容易被卤原子取代
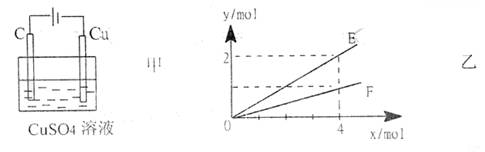
16、按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是 ( )
|
A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示生成硫酸的物质的量 D.F表示反应生成氧气的物质的量
17.近年查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,下列关于二氧化三碳的说法中错误的是( )
A.结构简式是 O=C=C=C=O B.C3O2、CO、CO2都是碳的氧化物
C.C3O2与CO都可以燃烧生成CO2 D. C3O2与CO2都是碳酸的酸酐
18.三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到:
![]()
下列有关NF3的叙述正确的是( )
A、NF3的氧化性比F2强 B、NF3是离子化合物
C、NF3中N呈-3价 D、NF3分子呈三角锥形
第Ⅱ卷(非选择题)
19.把淀粉和NaBr溶液装入半透膜袋,多次浸入蒸馏水中进行分离。请问:
(1)该分离方法称为 。
(2)怎样证明淀粉未透过半透膜而Br-已经透过半透膜?(仪器、试剂任用)
(3)怎样证明淀粉与NaBr已经分离完全?(仪器、试剂任用)
20.(14分)有四支干燥的小试管中,分别装有少量白色物质(约占试管容积的1/10),已知该白色物质肯定是碳酸氢铵、碳酸氢钠、碳酸钠或氯化钠中的一种,现通过加热试管中样品和使用蒸馏水、石蕊试液或pH试纸进行鉴定。
(1) 该实验的步骤怎样?
(2)请思考并填写下表:
| 白色物质 | 判断依据 | 有关化学方程式(或离子方程式) |
| 碳酸氢铵 | ||
| 碳酸氢钠 | ||
| 碳酸钠 | ||
| 氯化钠 |
21.某可逆反应为A(气)+B(气)![]() 3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
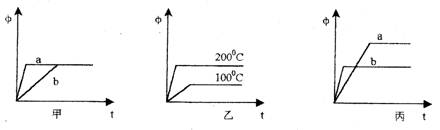
(1)若甲图中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。
(2)若乙图中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是
(选填吸热、放热)反应。
(3)若丙图中的a、b两条曲线分别表示在不同压强时的情况 ,则曲线 表示的是压强较大时的情况。
22.三聚氰酸![]() 可用于消除汽车尾气中的氮氧化物(如
可用于消除汽车尾气中的氮氧化物(如![]() )。当加热至一定温度时,它发生如下分解:
)。当加热至一定温度时,它发生如下分解:![]() (
(![]() 异氰酸,其结构是H–N=C=O)能和
异氰酸,其结构是H–N=C=O)能和![]() 反应生成
反应生成![]() 、
、![]() 和
和![]() 。
。
(1) 写出![]() 和
和![]() 反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收![]() 气体所消耗的三聚氰酸的质量?
气体所消耗的三聚氰酸的质量?
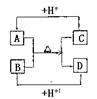
|
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别 代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为 x________,y__________,z________
(3)请分别用离子方程式说明结合质子能力x>y>z的判断依据:
x>y:___________________________________________
y>z:___________________________________________
24.将盛有 a molNO2和 b mol NO混合气体的试管倒立于水槽中,再通入 b mol O2,充分反应后试管里剩余的成分及物质的量决定于a与b的关系,请填写下列表格。
| Aa与b的关系 | 剩余气体成分 | 剩余气体物质的量 |
| 若a=b | ||
| (a-b)/3 | ||
| 剩余O2 |
25. 等物质的量的NaHCO3和KHCO3的混合物9.20g与l00 mL盐酸反应。
(l)试分析,欲求标准状况下生成的 CO2的体积时,还需什么数据(用a、b等表示,要注明单位)。
(2)求标准状况下生成的CO2的体积:
| 所需数据的取值范围 | 生成CO2的体积(标准状况) | |
| 盐酸不足时 | ||
| 盐酸过量时 |
(3)若NaHCO3和KHCO3不是等物质的量混合,则9.20g固体与盐酸完全反应时,在标准状况下生成CO2气体的体积大于_________L,小于____________L。
26.有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z。已知X是由a和b元素按原子个数比为1:1组成的化合物。
(一) 若Y是由c和b元素按原子个数比为1:1组成的化合物。,又知X分子含18个电子,化合物Y含32个电子,请填空:
①元素b在第 周期。②化合物X的分子式是 。③化合物Y的电子式是
(二)若a、b、c三种元素形成的单质(仍用a、b、c表示)和组成的化合物间反应关系式如下(未配平):
①b+c![]() Y
②a+c
Y
②a+c![]() Z
Z
③X+Y![]() m ④X+Z
m ④X+Z![]() c+n
c+n
⑤Y+Z![]() c+n
c+n
回答下列各题:
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是 (填序号),其充分理由是 。
(2) 如果m是一种无色、粘稠的油状液体化合物,则Y、Z分别是 ;
写出反应⑤的方程式 。
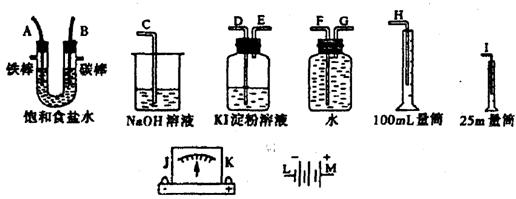
27. 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
(1)A极发生的电极反应式是________,B极发生的电极反应式是____________。
(2)电源、电流表,与A、B两极的正确连接顺序为L→( )→( )→( )→( )→M。
(3)设计上述气体实验装置时,各接口的正确连接依序为
_______ 接________、_________接A、B接_________、_________接__________。
(4)已知饱和食盐水50mL,电流强度为IA,通电为 t min时,测得H2体积为 16.8mL(标况),此时溶液 pH约为___________,阿伏加德罗常数表达式NA为___________________(电子电量为l.6×10-19C, lg3=0.5)
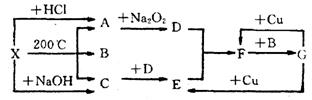 28. 右图表示的反应关系中,部分产物被略去,
X为l mol固体,A、B、C各为l rnol无色气体,
28. 右图表示的反应关系中,部分产物被略去,
X为l mol固体,A、B、C各为l rnol无色气体,
B在常温下为液体,D、E、F为气体,
G为液体。则(1) 写出化学式 X_________,C___________。(2) 写出化学方程式
A→D_____________________________
F→G_____________________________
(3) 实验室需测定F的式量, 测出的数据常比理论值大。其原因是____________________
___________________________________________(用方程式和必要的文字说明)
(4) 工业上合成C, 常用反应物___________和___________,合成后采用_________方法分离出_____________,能分离出该物质的原因是__________________________________。
29. 将一小块质量为 w g的焦炭和n g O2同时放入一个装有压力表的密闭容器中,压力所示为p0,当容器内充分发生反应后,恢复至原温度,压力表所示为p1 。如果pl是po的m倍(m>1),则w应满足的关系式是____________________,m的最大值是_______。
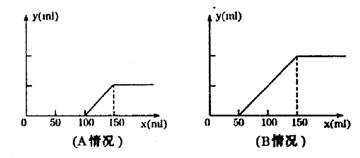 30. 分别取等物质的量浓度的氢氧化钠溶液各100ml,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):
30. 分别取等物质的量浓度的氢氧化钠溶液各100ml,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):
(1)在A情况下,溶质是(填化学式)___________,其物质的量之比为_______________。
(2)在B情况下,溶质是(填化学式)____________,其物质的量之比为_______________。
(3)在A、B两种情况下产生CO2的最大体积各为___________mL和_____________mL
(4)原氢氧化钠溶液的物质的量浓度为:______________________。
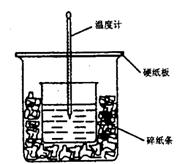 31.50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
31.50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(l)从实验装置上看,图中尚缺少的一种玻璃用品是 。由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 ;用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验,测得的中和热的数值会_ (均填“偏大”“偏小”“无影响”
32.(1991年)我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成CaO的质量.通常把1升水中含有10毫克CaO称为1度.水中的Ca2+和Mg2+可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应.
(1)现取某地区的地下水样品25.0毫升.用0.0100摩/升Y溶液滴定,完全反应时消耗Y溶液15.0毫升.试计算该地下水的硬度,并判断是否符合饮用水标准.
(2)如果每次分析时取的水样都是25.0毫升,为了便于计算.要求每消耗0.50毫升Y溶液即相当于水的硬度为1度.则Y溶液的摩尔浓度应为多少?
33.为测定固体烧碱中NaOH的质量分数C%是否在80%±2%的范围内(设烧碱中的杂质不与硫酸反应),取Wg样品配成500mL溶液,取出VmL的烧碱溶液用0.2000mol/L H2SO4标准溶液滴定。若要使到达滴定终点时,所滴入的0.2000mol/L H2SO4溶液的毫升数恰好等于C的1/4,则:
(1)应取多少毫升待测的样品溶液用于滴定?
(2)若希望取用20.00mL待测溶液用于滴定,则所称取的样品的质量W是 g。
(3)在题设条件下,若测定的固体烧碱的质量分数在80%±2%的范围内,则滴入的标准硫酸溶液的体积[可用V(H2SO4)表示]是 。
参考答案
一、选择题(1~18小题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | D | C | A | B | A | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | D | B | D | B | C | D | D |
19.(1)该分离方法称为_渗析_。(2)怎样证明淀粉未透过半透膜而Br-已经透过半透膜?(仪器、试剂任用)
取半透膜外的溶液样品2份,往1中加入少量碘水,溶液不显蓝色即可说明淀粉未透过半透膜;往2中加入少量硝酸银溶液,溶液有沉淀即可说明Br-已经透过半透膜。(3)怎样证明淀粉与NaBr已经分离完全?(仪器、试剂任用)
取半透膜内溶液样品,往其中加入少量硝酸银溶液,溶液无浑浊现象即可说明NaBr已经分离完全。
20.填表:(其他合理答案酌情给分,无润湿扣1分,次序有误扣1分)
| 白色物质 | 判断依据 | 有关化学方程式(或离子方程式) |
| 碳酸氢铵 | 加热产生的气体能使石蕊试液变蓝 | 分解方程式或氨气与水作用显碱性方程式 |
| 碳酸氢钠 | 加热产生的气体能使润湿石蕊试纸变红 | 分解方程式或CO2与水作用显酸性方程式 |
| 碳酸钠 | 加热不分解,晶体溶于水显碱性 | 水解方程式 |
| 氯化钠 | 加热不分解,溶解于水显中性 |
加热固体消失 , NH4HCO3==NH3+H2O+CO2
加热固体不消失,试管内有水珠 2NaHCO3== Na2CO3+H2O+CO2
加热固体无变化,其水溶液呈碱性。CO32-+H2O==HCO3-+OH-
加热固体无变化,其水溶液呈中性。
21.(1)曲线b、(2)吸热反应、(3)曲线b。
22 (1)8HNCO+6NO2=7N2+8CO2+4H2O
HNCO中的氮元素被氧化,NO2中的氮元素被还原?标出电子转移的方向和数目?
(2) 1.2Kg
23. ⑴[H:N:H]+ H:O:H ⑵OH- NH3 H2O)
⑶x>y: OH- +NH4+ ==NH3↑+H2O
y>z: NH3+H3O+ == NH4+ +H2O
24
| Aa与b的关系 | 剩余气体成分 | 剩余气体物质的量 |
| 无 | 0 | |
| 若a>b | NO | |
| 若a<b | (b-a)/4 |
25.解: ⑴盐酸的物质的量浓度 c mol/L
(2)设NaHCO3和KHCO3的物质的量均为x
x×84g/mol + x×100g/mol=9.2g x=0.500mol
如恰好反应时 n(HCl)=1.00 mol
盐酸不足时, n(HCl)<1.00mol c<10mol/L
用盐酸计算: V(CO2)=2.24c L
盐酸过量时 n(HCl)>1.00mol c>10mol/L
用NaHCO3和KHCO3计算: V(CO2)=22.4 L
| 所需数据的取值范围 | 生成CO2的体积(标准状况) | |
| 盐酸不足时 | 0<c<10 | 2.24c |
| 盐酸过量时 | c>10 | 22.4 |
(8分)
(3)若混合物全为NaHCO3, V(CO2)=9.2g ×22.4 L·mol-1 /84 g·mol-1 =2.45 L
若混合物全为KHCO3, V(CO2)= 9.2g ×22.4 L·mol-1 /100 g·mol-1=2.06 L
2.06L< V(CO2)<2.45L
26、解答:(一)① 二 ②H2O2 (二)(1)①②④⑤ 这些反应中有单质生成或单质参加反应 (2)SO2 H2S H2O2+SO2===H2SO4
27 ⑴ A极 : 2H++2e -== H2↑ B极: 2Cl--2e- =Cl2↑)⑵ L→J→K→A→B→M
⑶H接F,G接A,B接D,E接C(2分)⑷12.5, 2.5×1023 It
|
(3) 2NO2 N2O4 , 在NO2中混有N2O4测定式量大于理论式量。
(4)N2 H2 , 加压降温液化, NH3分子之间存在氢键, 作用力大,易液化。
29. 解: 气体压强正比于气体的物质的量
|
|
C(s)+O2(g) === CO2 (g) 2C(s)+O2 (g) === 2 CO (g)
m>1, 气体中应用CO2、CO 或CO p0 ∝ n/32 p1 ∝ n(CO2)+n(CO)
n(CO2)+n(CO)= p1×n/ p0×32=mn/32 n(C)= n(CO2)+n(CO)= mn/32
W(C)= 12×mn/32=3mn/8 m(max)=2 答: 略
30. 解: NaOH与CO2反应后溶液有下列4种情况
①NaOH Na2CO3 ②Na2CO3 ③Na2CO3 NaHCO3
④NaHCO3有关反应: NaOH+HCl==NaCl+H2O
Na2CO3+HCl==NaCl+ NaHCO3 HCl + NaHCO3 = CO2 ↑+NaCl+H2O
(1)生成气体消耗HCl的体积小于生成气体前消耗HCl的体积, 且体积比为1:2
原溶液是NaOH 、Na2CO3 且物质的量之比为1:1
(2)生成气体消耗HCl的体积大于生成气体前消耗HCl的体积, 且体积比为2:1
原溶液是Na2CO3 NaHCO3且物质的量之比为1:1
(3)A情况: V(CO2)=50mL×0.2mol·L-1×10-3L·mL-1×22.4 L·mol-1 =0.224L=224mL
B情况: V(CO2)=100 mL×0.2mol·L-1×10-3L·mL-1×22.4 L·mol-1=0.448L=448mL
(4)A情况: HCl的体积50mL时, 溶液是NaCl溶液
c(NaOH)=0.150L×0.2mol·L-1/0.1L=0.30mol/L 答: 略
31、(l)环形玻璃搅拌棒;在大小烧杯间填满碎泡沫(或纸条)使小烧杯口与大烧杯口相平 (2)减少实验过程中的热量损失 (3)偏小 (4)不等;相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。与酸、碱的用量无关 (5)偏小;偏小
32 答案:(1)25.0毫升水中含Ca2+和Mg2+的总物质的量为
0.0100×0.0150=1.50×10-4(摩)
折合成CaO的质量为1.50×10-4×56=8.40×10-3(克)(1分)
![]()
因硬度超过25度,故不符合饮用水标准.)
或列成总式:
![]()
因硬度超过25度,故不符合饮用水标准.
(2)[解法一]
25.0毫升水(硬度为1度)中含CaO的物质的量为
![]()
![]()
[解法二][利用(1)的结果计算]
设Y溶液的浓度为C,则(0.0100×15.0):33.6=(C×0.50):1
C=8.92×10-3(摩/升)
33(1) 因为样品W克故有NaOH为WC%克,取出参加反应的NaOH为WC%×V/500克
∴V=200÷W (ml) (2)V=20 W=10g
(3) 当 C=80-2=78 ∴ V=C/4=78/4=19.50ml 当 C=82 ∴ V=20.50ml