高三化学同步测试(2)
本试卷分I卷和Ⅱ卷两部分。第Ⅰ卷为选择题,本卷考试时间:120分钟, 满分:150分。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Cu-64 Fe-56 S-32
第Ⅰ卷 选择题 (满分72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1. 航天科学技术测得, 三氧化二碳(C2O3) 是金星大气层的成分之一。下列关于C2O3的说法正确的是 ( )
A. C2O3和CO2是同素异形体 B. C2O3和CO 燃烧产物都是CO2
C. C2O3和CO 都是酸性氧化物 D. C2O3和CO2都是碳酸的酸酐
2. 用特殊方法把固体物质加工到纳米级(1nm~100nm, 1nm= 10-9 m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是
( )
A. 胶体 B.溶液 C. 悬油液 D.乳浊液
3. 下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A. SO2和SiO2 B.CO2和H2O C. NaCl和 HCl D. CCl4和 KCl
4. 铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在①制铝锭;②制易拉罐;③制电线电缆;④制牙膏皮;⑥用明矾净水;⑦制炊具;⑧用明矾和苏打作食物膨化剂;⑨用Al(OH)3制成药片治胃病;⑩制防锈油漆等使用场合中。必须加以控制的是 ( )
A. ①②④⑤⑥⑦⑧ B. ②⑤⑥⑦⑨ C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
5. 天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:
|
|
![]()
![]() CH4+ 2O2 CO2+ 2H2O, C3H8+
5O2 3CO2+4H2O
CH4+ 2O2 CO2+ 2H2O, C3H8+
5O2 3CO2+4H2O
现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是 ( )
A.增大空气进入量或减小石油气进入量
B.减小空气进入量,增大石油气进入量
C.减小空气进入量,减小石油气进入量
D.减小空气进入量或增大石油气进入量
6. NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是( )
A.跟水反应时,水作氧化剂 B. NaH中H-半径比Li+半径小
C. 跟液氨反应时,有NaNH2生成 D. 跟乙醇反应时,NaH被氧化
7. 已知在一定条件下,Cl2、ClO2(其还原产物为 Cl-)、O3(l mol O3转化为 l molO2和molH2O)、H2O2等物质都具有氧化性,因而常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 ( )
A. C12 B. ClO2 C. O3 D. H2O2
8. 硼有两种天然同位素105B、115B, 硼元素的近似相对原子质量为10.8, 则对硼元素中的105B质量分数判断正确的是 ( )
A. 20% B.略小于20% C. 略大于20% D. 80%
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9. 对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ( )
A . Br- B. SO42- C. H2SO3 D. NH4+
10.下列叙述正确的是 ( )
A. 两种微粒,若核外电子排布完全相同,则化学性质一定相同
B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同一种元素
D. 阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
11.下列离子方程式不正确的是 ( )
A. 向NaHSO4溶液中加入Ba(OH)2溶液呈中性
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.向NaAlO2溶液中加入过量盐酸,至溶液呈酸性
AlO2+ H++H2O==Al(OH)3 ↓
C.在碳酸氢铵溶液中加入过量的NaOH溶液
NH4++HCO3- + 2OH—==NH3↑+CO32-+2H2O
D. 往苯酚钠溶液中通入足量的CO2
2![]() +CO2+H2O→2
+CO2+H2O→2![]() + CO32-
+ CO32-
12. 物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成型的生物原电池,下列有关判断正确的是 ( )
A.正极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
B.负极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
C.负极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
D.正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
13.在一定体积和一定条件下有反应N2+3H2![]() 2NH3,现分别从两条途径建立平衡:
2NH3,现分别从两条途径建立平衡:
I.起始浓度 N2 l mol·L-1, H2 3 mol·L-1
II. 起始浓度 N2 2 mol·L-1, H2 6 mol·L-1
下列叙述正确的是
A. I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,I途径的反应速率v(H2)等于II途径的反应速率v(H2)
C.达到平衡时,I途径体系内混合气体的密度为途径II体系内混合气体的密度的![]()
D.达到平衡时,II途径体系内混合气体的压强是I途径内混合气体压强的2倍
14.沼气是一种能源,它的主要成分是 CH4,0.5 mol CH4完全燃烧生成 CO2和 H2O时,放出 445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)→2CO2(g)+4H2O(1);△H=+890kJ·mol-1
B.CH4(g)+2O2(g)→CO2(g)+2H2O(1);△H=+445kJ·mol-1
C. CH4(g)+2O2(g)→CO2(g)+2H2O(1); △H=-890kJ·mol-1
D. ![]() CH4(g)+O2(g)→
CH4(g)+O2(g)→![]() CO2(g)+H2O(1);△H=-445kJ·mol-1
CO2(g)+H2O(1);△H=-445kJ·mol-1
15.化学工作者把烷烃、烯烃、环烷烃、炔烃、……的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大方便。设键数为I则烷烃中碳原子数跟键数的关系的通式为CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数跟键数关系的通式为CnI3n,则苯的同系物中碳原子数跟键数关系的通式为 ( )
A.CnI3n-1 B.CnI3n-2 C.CnI3n-3 D.C nI3n-4
16.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡: Cu2+ +SO42- +x H2O![]() CuSO4·xH2O ,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是 ( )
CuSO4·xH2O ,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是 ( )
A.溶液中Cu2+浓度增大 B.溶液中Cu2+数目减少
C.该硫酸铜晶体体积增大 D.溶液的蓝色变浅
17. “喷水溶液法” 是日本科学家最近研制出的一种使沙漠变绿洲的技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30cm~50cm处形成一个厚0.50cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水作用,下列对聚丙烯酸酯的说法错误的是 ( )
A. 它的单体的结构简式为CH2=CHCOOR
B.它在一定条件下能发生加成反应
C.它在一定条件下能发生水解反应
D.它没有固定熔沸点
18.下列各组溶液混合后,溶液的PH一定大于7的是 ( )
A. 含等物质的量的HNO3、Na2CO3、CH3COOH溶液混合
B. pH= 2的盐酸和 pH=12的氨水等体积混合
C.pH= 3的某酸和 pH= 11的某碱等体积混合
D.pH=2的CH3COOH和pH=12的NaOH溶液等体积混合
第Ⅱ卷 非选择题 (满分78分)
三、(本题包括2小题,共22分)
19. (10分)某学生为测定氯化铵与硫酸铵混合物中氯化铵的质量分数,按下图所示实验步骤进
行实验:
![]() 滤液B
滤液B
称量样品 → 溶解 → 滴加过量溶液A → 过滤
沉淀 → 洗涤 → 烘干 → 物质C
请回答下列问题:
(1)物质C的化学式是________;
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右
盘样品的实际质量是____________;
(3)若过滤用的仪器和用品已有滤纸、铁架台、铁圈、烧杯、漏斗等,还需要的仪器
或用品是_____________________________;
(4)证明A溶液滴加过量的操作方法是
____________________________________________________________;
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数为____________。
20. (12分)某学生设计了一个制取氢氧化亚铁的最佳实验方案,实验装置见图,请分析实验过
程:
(1)在B试管中加入NaOH溶液后加热煮沸l-2分钟立即加入2mL液体石蜡,该操作
目的是______________________________________。
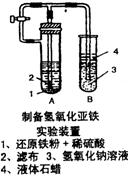 (2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为
(2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为
什么铁粉过量 。
(3)连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关
闭活栓,这时看到A试管中_____________________现象,原因
是____________________________________。
B试管中现象为___________________________________。
(4)如B中产生的氢氧化亚铁遇空气,发生变化的化学方程式为_______________。
四、(本题包括2小题,共20分)
21.(6分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 _______________ 。
22.(14分)已知25℃时0. l mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释;甲同学认为主要是醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为主要因为醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使对c(H+)减小,因此溶液的pH增大。你认为上述两种解释中________(“甲”或“乙”)正确。
(1)为了验证上述哪种解释正确,继续做如下实验:向0. l mol·L-1的醋酸溶液中加入少量下列物质中的__________(填写编号),然后测定溶液的pH。
A. 固体CH3COOK B.固体CH3COONH4 C.氨气 D.固体NaHCO3
若______(填“甲”或“乙”)的解释正确,验证实验中,溶液的pH应_______(填“增大”、“减小”或“不变”)。
(2)常温下将 0.010molCH3COONa和0.0040mol HCl溶于水,配制成 0.50L混合溶液。判断:
①溶液中共有__________种离子。
②溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是________和________。
③溶液中n(CH3COO-)+n(OH一)-n(H+)=_______mol。
五、(本题包括2小题,共17分)
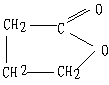
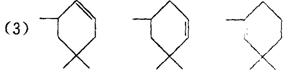
23.(7分)萝卜中具有较多的胡萝卜素,它是人体的主要营养之一。α—胡萝卜素的结构为:
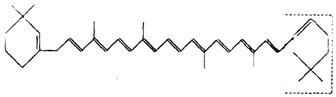
(1)写出α—胡萝卜素的分子式__________________。
(2) l mol胡萝卜素最多能与________mol Br2反应。
(3)β—胡萝卜素与α—胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳的骨架相同,写出β—胡萝卜素方框内所有可能的结构简式:
___________________________________________________________________。
|
某高分子化合物(C4H5Cl)n发生如下转化:
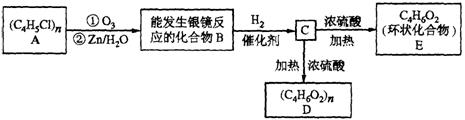
(1)写出A、E的结构简式:A______________;E____________________。
(2)写出B转化为C的化学方程式:________________________________________。
(3)写出C转化为D的化学方程式:________________________________________。
六、(本题包括2小题,共19分)
25. ( 6分)将盛有10mL由NO2和O2组成的混合气体的大试管,倒立于水槽中,待反应完毕后, 试管中还残留l mL无色气体.求原混合气体可能的体积组成。
26.(12分)在恒温时,向某密闭容器中通入2molX和 1molY气体,发生如下反应: 2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
(l)与上述平衡保持同温、同压,若向密闭容器中通入4 molX(g)和 2 mol Y(g),达到平衡,则Z的体积分数为_____________;平衡时,气体的总物质的量是_____________。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和 Y(g)的物质的量分别记为 n(X)、n(Y),并满足平衡时Z的体积分数为0.4,则![]() 的取值范围为______________。
的取值范围为______________。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | A | B | C | A | B | B | B | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | BD | AC | C | CD | C | BC | B | AB |
19. (1) BaSO4 (2)15.6g (3)玻璃棒 (4)用一试管取过滤最后一次滤液,向试管中加入稀硫酸,若有沉淀,则BaCl2己过量。 (5)20% ( 每空2分) 本小题共10分
20.(1)驱除溶在NaOH溶液中的氧气,防止氧气再进入。
(2)保证溶液中不存在Fe3+。 (3)试管中溶液经导管压入B试管,因为生成的氢气产生的压力,产生白色沉淀。 (4)4Fe+ O2+2H2O==4Fe(OH)3 ( 每空3分) 本小题共12分
21. Na2O、K2S、MgF2、CaCl2 本小题共8分
22. 乙 ( 1分) (1)B (2分), 甲、不变(乙、增大) ( 3分) (2) ①5 ②CHCOO-、CHCOOH ③0.0060mol ( 每个2分) 本小题共12分
五、(本题包括2小题,共20分)
23. (1) C33H54 (2分)
(2)11 (2分)
 (3分)本小题共7分
(3分)本小题共7分
24. (1)[CH2CH=CClCH2]n, (2分)
(2分)
|
![]() (2)OHCCH2CH2COOH+H2
HOCH2CH2COOH (3分)
(2)OHCCH2CH2COOH+H2
HOCH2CH2COOH (3分)
|
![]() (3)n HOCH2CH2COOH [OCH2CH2CO]n+nH2O(3分) 本小题共10分
(3)n HOCH2CH2COOH [OCH2CH2CO]n+nH2O(3分) 本小题共10分
六、(本题包括2小题,共19分)
25 ①V(NO2)=7.2mL V(O2)=2.8mL (3分)
②V(NO2)=8.6mL V(O2)=1.4mL (3分) 本小题共6分
26. 解:(1)恒温恒压下两平衡等效。 0.4 (3分)
2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始/mol 4 2 0
变化/mol 2a a 2a
平衡/mol 4-2a 2-a 2a
![]() =0.4 a=1 n(总)=6mol-a mol=5mol (3分)
=0.4 a=1 n(总)=6mol-a mol=5mol (3分)
(2) 2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始/ mol m n 0
变化/ mol 2b b 2b
平衡/ mol m-2b n-b 2b
![]()
![]() =0.4
=0.4
m-2b>0
n-b>0
0.5<![]() <5
即 0.5<
<5
即 0.5<![]() <5 (6分) 本小题共12分
<5 (6分) 本小题共12分