2003-2004学年度下学期
高中学生学科素质训练
高三化学同步测试(3)
本试卷分I卷和Ⅱ卷两部分。第Ⅰ卷为选择题,本卷考试时间:120分钟, 满分:150分。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 K-39 Al-27 Cl-35.5
第Ⅰ卷 选择题 (满分72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.下列做法不利于改善环境的是 ( )
A. 焚烧农作物秸秆 B.提倡使用农家肥
C.用H2作还原剂冶炼金属 D.限制燃油汽车数量的增加
2. 水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是( )
A. 蒸馏法是海水淡化的方法之一
B. 淡水的密度小于海水的密度
C. 融化的雪水中矿物质含量比深井水中的少
D. 0℃以上,温度越高,水的密度越小
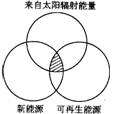 3.“能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
3.“能源分类相关图”如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
A. 煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
4. 下列离子化合物中阳离子半径和阴离子半径之比最大的是 ( )
A. LiI B.NaBr C. KCl D. CsF
5.将某溶液逐滴加入Fe(OH)3溶胶中,开始时产生沉淀,继续滴加沉淀又溶解,该溶液是
( )
A. 2 mol·L-1 HCl溶液 B. 2 mol·L-1 NaOH溶液
C. 2 mol·L-1 MgSO4溶液 D.硅酸溶液
6.下列除去杂质的方法正确的是 ( )
A. 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B. 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
7. 已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是 ( )
A. LiOH加热时,不会分解 B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2 D.Li与稀硫酸反应生成Li2SO4
8. 已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52 mol·L-1,试判断47.5%酒精溶液的物质的量浓度为 ( )
A. 大于 8.26 mol·L-1 B. 等于 8.26 mol·L-1
C. 小于 8.26 mol·L-1 D.无法判断
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9. 1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是 ( )
A. 该元素属于第七周期
B.该元素位于ⅢA族
C.该元素为金属元素.性质与82Pb相似
D.该同位素原子含有114个电子,184个中子
10.某无色透明的溶液,水电离出c(H+)=10-14 mol·L-1,在该溶液中一定能大量共存的是
( )
A. Fe2+、K+、SO42-、NO3- B.Mg2+、NH4+、SO42-、Cl-
C. Na+、K+、SO42-、NO3- D. Ba2+、Na+、MnO4-、SO42-
11.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入了少量氢氧化钠溶液 HCO3- +OH-==CO32-+H2O
B.氯化铁溶液中通入硫化氢气体 2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入二氧化硫 Ca2++2ClO-+H2O+SO2==CaSO3+2HClO
D.氯化亚铁溶液中加入硝酸 3Fe2++4H++NO3-==3Fe3++2H2O+ NO↑
12. 设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A. 2.7g金属铝变为铝离子时失去了电子数目为0.3NA
B.在常温、常压下,11.2L N2含有分子数为0.5NA
C.在常温、常压下,l mol Ne(氖气)含有的原子数为NA
D.在同温、同压下,相同体积中的任何气体单质所含的原子数相同
13.下图是氯化铯晶体的晶胞示意图。所谓晶胞即晶体中最小的重复结构单元。已知该晶体中2个最近的Cs+离子的核间距离为acm, 氯化铯的摩尔质量为Mg·mol-1。设NA为阿佛加德罗常数,则氯化铯晶体的密度是 ( )
A. 8M/NAa3 g·cm-3 B. M a3/8NA g·cm-3
C. M/NAa3 g·cm-3 D. M a3/NA g·cm-3
14. 在相同状况下,对于质量相同的H2、D2、T2:①密度之比为 l: 2: 3②质子数之比为 6: 3 :2③中子数之比为0:3:4④体积之比为6:3:2,下列叙述正确的是 ( )
A. 都正确 B.①② C.①②③ D.①③④
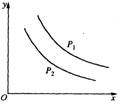 15. 反应L(s)+aG(g)
15. 反应L(s)+aG(g)![]() bR(g)达到平衡时,温度和压强对
bR(g)达到平衡时,温度和压强对
该反应的影响如图所示。下图中:压强P1>P2,x轴表示温度,y
轴表示平衡混合气中G的体积分数。据此可判断 ( )
A. 上述反应是放热反应 B.上述反应是吸热反应
C. a>b D. a<b
16. 常温下,0.lmol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)恒等于 10-8 mol·L-1,下列叙述正确的是 ( )
A. 溶液中水电离出的 c(OH-)=10-10 mol·L-1
B.溶液中 c(HA)+c(H+)=0.1mol·L-1
C.与 0.lmol·L-1 NaOH溶液等体积混合所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
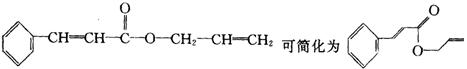
17. 对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1-丙烯酯:
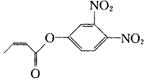 杀虫剂“阿乐丹”的结构表示如右式:若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是
杀虫剂“阿乐丹”的结构表示如右式:若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是
A. 遇FeCl3溶液均显紫色 B. 均能发生银镜反应
C. 均能与溴水发生加成反应 D.均能与NaOH溶液发生反应
18.某温度下,甲、乙两个烧杯中各盛有100 g相同浓度的KCl溶液,现将甲烧杯中的溶液蒸发掉35gH2O,析出晶体5g;乙烧杯中的溶液蒸发掉45gH2O,析出晶体10g。则原溶液的质量分数为 ( )
A. 10% B. 15% C. 20% D. 25%
第Ⅱ卷 非选择题 (满分78分)
三、(本题包括2小题,共19分)
19. (8分)简述浓硝酸的保存, 并说明理由。(可不填满, 也可补充)
①_____________,______________________________________________________;
②_____________,______________________________________________________;
③_____________,______________________________________________________;
④_____________,______________________________________________________;
⑤_____________,______________________________________________________。
20.(11分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制乙醛,装置如下图所示,请回答下列问题;
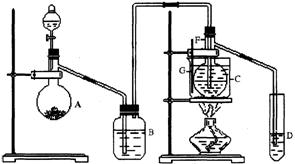
(1)实验开始时,仪器A中盛放电石,B中应装____________,其作用是
______________________________________________________________________。
(2)仪器D中盛放水,其作用是_________________________________________________。
(3)蒸馏烧瓶 F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称_________________________________。将HgO加放F中的振作方法是___________________________________。
(4)装置图中,加热F的方法叫___________,所选用温度计G的量程表示正确的是______。 (填代号)。
A. 0℃~50℃ B.0℃~100℃ C. 0 ℃~200℃
D. 50 ℃~100 ℃ E. 0℃~360℃
(5)检验乙醛已制出的操作及现象是______
__________________________________________________________________。
四、(本题包括2小题,共20分)
21.(10分)某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验序号 温度/℃ 0 10 20 30 40 50 60
1 800 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800 c1 0.60 0.50 0.50 0.50 0.50 0.50
3 800 c2 0.92 0.75 0.63 0.60 0.60 0.60
4 820 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空;
(1)在实验1,反应在l0min至20 min时间内平均速率为_____________mol·L-1
(2)在实验2,A的初始浓度c2= _________mol·L-1,反应经就达平衡,可推测实2中还隐含的条件是_________________________________.
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3_υ1;(填>、=、<=,且C3 _________mol·L-1 (填>、=、<)
(4)比较实验4和实验1,可推测该反应是_________________反应(选填吸热、放热).
22. (10分)有 A、B、C、D四种单质,在一定条件下,A、B、C分别跟 D发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B跟C发生化合反应生成丁,这些单质和化合物之间发生如下反应关系: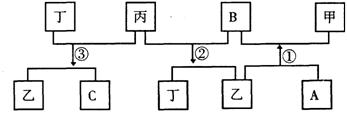
(1)写出下列物质的化学式
甲______________乙___________丙_____________丁_____________
(2)写出反应①②③的化学方程式
①____________________________________
②_________________________________________
③_________________________________________________________。
五、(本题包括2小题,共22分)
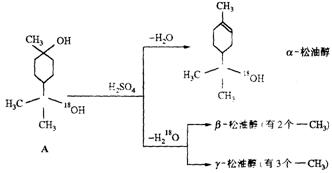 23.(10分)松油醇是一种调香香精,
23.(10分)松油醇是一种调香香精,
它是α、β、γ三种同分异构体
组成的混合物,可由松节油分馏
产品A(下式中的18是为区分两
个羟基而人为加上去的)经下列
反应制得:试回答:
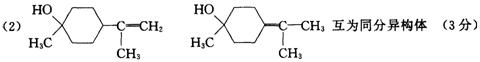
(1)α—松油醇的分子式________;α—松油醇所属的有机物类别是_____________。
(2)写结构简式:β—松油醇_____________,γ一松油醇_______________,它们的关
系是______________。
(3)α—松油酸能发生的反应类型有_________________________________。
24.(12分)已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:
![]()
![]()
![]() +H2O
+H2O
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。
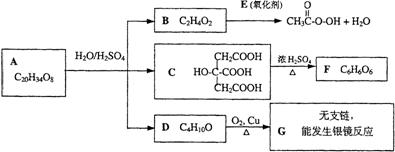
(1)CH3COOOH称为过氧乙酸,写出它的一种用途 。
(2)写出B+E→CH3COOOH+H2O的化学方程式 。
(3)写出F可能的结构简式 。
(4)写出A的结构简式 。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比
是 。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:
。
六、(本题包括2小题,共17分)
25.(6分)对牛奶中的蛋白质进行下列实验:取 30 mL牛奶,用盖达尔法分解蛋白质,把氮完全转化为氨,用0.500mol·L-1的 H2SO4溶液 50.0mL吸收后,剩余的酸用 38.0mL1.00mol·L-1的 NaOH溶液中和。
(1)30 .0 mL牛奶中共含有多少克氮?
(2) 己知牛奶的密度1.03g·mL-3, 蛋白质中含氮的质量分数为16.0%,求牛奶中氮的质量
分数为多少?
26.(11分)常温(25℃)常压下,有以等物质的量混合的A、B、C三种气态烷烃的混合物2L,完全燃烧时,消耗O211.0L(相同状况下)。若在压强不变的条件下,将原混合气体2L降温至5℃,则气体体积减少到原来 93.3%。
(1)已知分子中碳原子数n≥5的烷烃在5℃时为液态,试推断原混合气体中是否含有n
≥5的烷烃。
(2)试通过计算和推理判断原混合物的组成,写出A、B、C三种烷烃的结构简式。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | C | D | A | C | D | A | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | AC | C | A | BD | BD | D | C |
19. ①棕色瓶、防止见光分解;
②玻璃塞、硝酸具强氧化性, 腐蚀橡皮塞;
③细口瓶、硝酸液状, 便宜倾倒;
④冷暗处、防止硝酸受热或见光分解。 本小题共8分
20.(1) NaOH溶液, 除去由A装置导出的气流中混有的H2S (3分)
(2) 吸收乙醛蒸气(2分)
(3)氧化汞→水→浓硫酸; 将蒸馏烧瓶横置, 用药匙或纸槽将粉末送至底部, 再慢慢竖立即可(2分)
(4)水浴加热,B (2分)
(5)取D中少量溶液, 加入新制氢氧化铜悬浊液加热若产生红色沉淀即可证明乙醛已生成。(2分) 本小题共11分
21. (1)0.013 实验过程中使用了催化剂
(2)> (3)吸热 温度升高时,平衡向右移动 ( 每空2分) 本小题共10分
22. (1) HF、H2O、NH3、NO( 每空1分)
(2) 2F2 + 2 ==4HF+ O2 4NH3+ 5O2==4NO +6H2O 4NH3+ NO==5N2 +6H2O
( 每空2分) 本小题共10分
23.(l) C10H1818O(2分)不饱和一元醇(l分)
(3)加成 氧化 消去 取代(酯化) (4分) 本小题共10分
24.(1) 杀菌消毒(1分)
(2)CH3COOH +H2O2 →CH3COOOH+ H2O(2分)
(3) 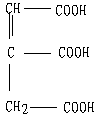
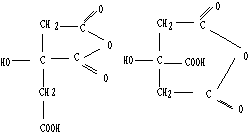 (3分)
(3分)
(4)CH3COOC(CH2COOCH2CH2CH2CH3)2 COOCH2CH2CH2CH3(2分)
(5) 4:3 (2分) △
(6) CH3CH2CH2CH2OH+HBr → CH3CH2CH2CH2Br+H2O(2分)本小题共12分
五、(本题包括2小题,共20分)
25.(1) n(N)=n(NH4+)=2n(H2SO4)-n(NaOH)
=2×0.0500mol·L-1×50.0mL-38mL×1.00 mol·L-1=12mmol
m(N)=12mmol×14g·mol-1=168mg=0.168g (3分)
(2)m(蛋白质)=0.168g÷16%=1.05g
ω(蛋白质)=1.05g÷(30mL×1.03g·mL-1)=0.0340(3分) 本小题共6分
26. 解: (1) V(后)/ V(前)=T(后)/ T(前)=278K/298K=0.993,
原混合气体中无n≥5的烷烃。(3分)
(2) 设混合气体的平均组成为CxH2x+2
CxH2x+2 +(x+![]() )O2 →xCO2+(x+1)H2O
)O2 →xCO2+(x+1)H2O
x+![]() =5.5
x=
=5.5
x=![]() (2分)
(2分)
则A、B、C的含碳组合有
| 组合 | n(A) | n(B) | n(C) |
| ① | 3 | 3 | 4 |
| ② | 2 | 4 | 4 |
上述①组不成立。
则A、B、C的结构简式有
| 组合 | A | B | C |
| ① | CH3CH3 | CH3CH2CH2 CH3 | (CH3)2CHCH3 |
| ② | CH3CH3 | (CH3)2CHCH3 | CH3CH2CH2 CH3 |
(6分) 本小题共11分