高中学生学科素质训练
高三化学同步测试(4)
本试卷分I卷和Ⅱ卷两部分。本卷考试时间:120分钟, 满分:150分。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 Na-23 Ca-40 K-39 I-127 Fe-56 Cl-35.5
第Ⅰ卷 选择题 (满分72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1. 宇宙中元素含量最高的是 ( )
A. H元素 B. C元素 C. O元素 D. He元素
2. 下列说法中不正确的是 ( )
A.人类历史上使用最早的合金是青铜,目前世界上使用量最大的合金是钢
B. 从金属矿石中提炼金属一般步骤依次是:矿石的富集、精炼、冶炼
C.硫酸的消费量常被视为一个国家工业发达水平的一种标志
D.能源、信息、材料通常被称为新科技革命的三大支柱
3. 美国加州 Livermore国家实验室物理学家Choong—Shik和他的同事们,在40Gpa的高压容器中, 用Nd:YbLiF4激光器将液态二氧化碳加热到1800K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是 ( )
A.该晶体仍属于分子晶体 B. 硬度与金刚石相近
C. 熔点较低 D. 硬度较小
4. 能够用键能的大小作为主要依据来解释的是 ( )
A. 常温常压下氯单质与溴单质的状态不同 B. 氯化钠的熔点比碘化钠高
C. 稀有气体一般难于发生化学反应 D. 铝的化学性质比铁活泼
5. 蓄电池是一种可反复充电、放电的装置。某种蓄电池充电和放电时发生的反应为:
|
A. Fe B.NiO2 C.Fe(OH)2 D.Ni(OH)2
6.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止富脂食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质,下列不属于抗氧化物质的是
( )
A.生石灰 B.还原铁粉 C.亚硫酸钠 D.维生素C
7. 下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A. H2O B. BF3 C. CCl4 D. PCl5
8. 在一恒容的容器中充入2molA和1molB发生反应2A(g)+B(g) ![]() xC(g),达平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器, 达平衡后,C的体积分数仍为W%。则x的值为( )
xC(g),达平衡后,C的体积分数为W%。若维持容器中的容积和温度不变,按起始物质的量:A为0.6mol,B为0.3mol,C为1.4mol充入容器, 达平衡后,C的体积分数仍为W%。则x的值为( )
A.只能为2 B. 只能为3
C.可能是2,也可能是3 D. 无法确定
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9. 下列家庭化学小实验不能达到预期目的的是 ( )
A. 用米汤检验食用加碘盐(KIO3)中含有碘
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用碘酒验证汽油中是否含有不饱和烃
D. 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验
10. NA表示阿伏加德罗常数,下列说法正确的是 ( )
 A.如果5.6 L N2含有n个氮分子,则NA一定约为4n
A.如果5.6 L N2含有n个氮分子,则NA一定约为4n
B. 在常压、室温条件下,lmol氦气含有的原子数为NA
C.在100 mL 0.5 mo1·L-1乙酸溶液中含乙酸分子数为0.05NA
D.15.6g Na2O2与过量CO2反应时,转移的由于数为 0.2 NA
11.右图是制取和收集某气体的实验装置,可用于 ( )
A. 用Zn与稀HCl反应制H2 B.用Na2O2与H2O反应制O2
C.用Cu与稀HNO3反应制NO D.用MnO2与浓HCl反应制Cl2
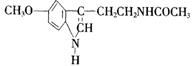 12.脑白金,其有效成分的结构简式为右式,下列对该化合物
12.脑白金,其有效成分的结构简式为右式,下列对该化合物
的叙述正确的是 ( )
A. 它属于芳香烃 B.它属于高分子化合物
C.分子式为C13N2H16O2 D. 在一定条件下可以发生加成反应
13. 在含有I一且能使酚酞变红的无色溶液中,可大量存在的离子组是 ( )
A. Na+、Cu2+、Br一、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、Na+、NO3-、H+ D. K+、S2-、SO42-、OH-
14. 砒霜的主要成分是As2O3,剧毒,致死量为0.1g。As2O3是两性偏酸性氧化物,微溶于水,生成H3AsO4;该酸及其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐均几乎不溶于水。下列关于处理一瓶含有砒霜废液的方案中正确的是( )
A. 直接倒入下水道 B.经过滤后倒入下水道
C. 加入足量生石灰后,倒入指定地点 D. 加入足量氢氧化钠后,倒入指定地点
15. 下列用来表示物质变化的化学用语中,正确的是 ( )
A. 钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
B. 明矾水解的离子方程式: Al3++3
H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.氢氧化钙溶液与碳酸氢钠溶液混合:OH-+ HCO3一=H2O+ CO32-
D.可表示氢气燃烧的热化学方程式2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
16. 2003年中国载人航天飞船“神舟” 号是用 N2H4(联氨)与N2O4作推力能源,其未配平的反应式为N2O4+ N2H4→N2+H2O,下列说法正确的是 ( )
A. N2既是氧化产物又是还原产物
B. 氧化产物与还原产物物质的量之比为1:2
C. 联氨是氧化剂
D.氧化剂与还原剂物质的量之比为2:1
17.体积相同,浓度均为 0. l mol·L-1的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为 ( )
A. 4m=n B.m=n C.m<n D.m>n
18. 将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液满加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前滤液中 FeSO4的物质的量浓度为 ( )
A.2 mol·L-1 B. l.8 mol·L-1 C.1.9 mol·L-1 D. 无法计算
第Ⅱ卷 非选择题 (满分78分)
三、(本题包括2小题,共20分)
19. (7分)(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成
像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。答:
(2)要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
(填代号)。
A. 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C. 称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D. 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
20.(13分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”中制取NaHCO3实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末.有NH4Cl晶体析出。……
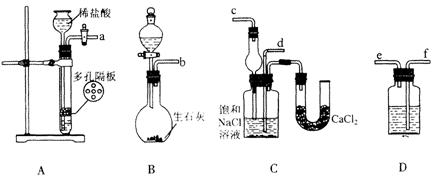
请回答下列问题:
(l)装置的连接顺序是:(a)接( ) ( )接( );(b)接( )
(2)A中常选用的固体反应物为___________;D中应选用的液体为_________;B中发生反应的化学方程式为________________________________________________。
(3)第二步骤中必须先让________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是____________,C中广口瓶内产生固体 的总化学方程式为_________________________________________________。
(5)第四步中分离出 NH4Cl晶体的操作是___________;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:______________________
________________________________________________________________ 。
四、(本题包括2小题,共20分)
21.(8分)已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①(Cl一)>c(NH4+)> c(H+)> c(OH-) ②c(Cl一) >c(NH4+)> c(OH-)> c(H+)
③c(NH4+)>c(Cl一)> c(OH-)> c(H+) ④ c(Cl一) >c(H+)> c(NH4+)> c(OH-)
填写下列空白:
(1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为_______________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为____________________;
若上述关系中④是正确的,则溶液中的溶质为________________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于”、下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。
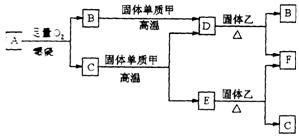 22.(12分)气体 A只含 X、Y两种短周期
22.(12分)气体 A只含 X、Y两种短周期
元素,X的原子序数大于 Y的原子序
数。 B、D、E是中学化学中的常见气
体。固体乙是一种复杂的化合物,是具
有磁性的黑色晶体;F是目前用途最广、
用量最大的金属单质,F与C在高温下发生反应生成Z和固体乙。各物质有如下图所示
的转化关系。
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)__________。
(2)若气体A的分子为线型结构,且X与Y两元素的质量比数值上等于X的相对原子质量,则X元素位于周期表________周期,________族,A的电子式为_______________。
(3)写出下列反应的化学方程式(是离子反应的,写离子方程式):
在高温下,C与固体甲反应_________________________________________________,
在高温下,F与C反应 ____________________________________________________,
F与足量稀HNO3反应 ____________________________________________。
四、(本题包括2小题,共19分)
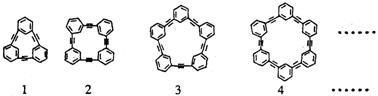 23.(10分) 自20世纪90年代以
23.(10分) 自20世纪90年代以
来,芳炔类大环化合物的研
究发展十分迅速,具有不同
分子结构和几何形状的这
一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙
炔(CH≡C-![]() )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构如
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构如
上式:
(1)上述系列中第1种物质的分子式为 。
(2)已知上述系列第1至第4种物质的分子直径在1~100nm之间,分别将它们溶解于有机溶剂中,形成的分散系为 。
(3)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(4)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH-![]() )为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
)为起始物质,通过加成、消去反应制得。写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
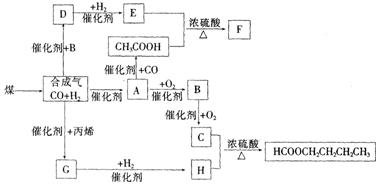
24.(9分)煤的气化和液化是使煤
变成清洁能源的有效途径。
煤气化的主要反应是:
|
C+H2O(g)=== CO+H2,
CO和 H2的混合气体是合
成多种有机物的原料气。右图是合成某些物质的路线。其中,D易溶于水,且与 CH3COOH
互为同分异构体;F分子中的碳原子数是 D的 3倍;H经催化氧化可得到G。请回答
下列问题:
①写出下列物质的结构简式:
A__________________、H_____________________;指出A和H的关系_________。
②写出下列反应;
D与新制Cu(OH)2共热 _____________________________
③E→F ___________________________________________________________。
四、(本题包括2小题,共19分)
25. (9分)为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
26.(10分)已知;标准状况下。1体积水能溶解2.3体积氯气,其中约有![]() 的氯气和水发生反应。20℃时,氯化钠的溶解度为36g,饱和溶液的密度为1.18g·cm-3,20℃时,饱和盐酸溶液的质量分数约为37%,溶液密度为1.19g·cm-3。
的氯气和水发生反应。20℃时,氯化钠的溶解度为36g,饱和溶液的密度为1.18g·cm-3,20℃时,饱和盐酸溶液的质量分数约为37%,溶液密度为1.19g·cm-3。
(1)计算20℃时饱和氯化钠溶液和盐酸溶液的物质的量浓度。
(2)通过计算说明20℃时,当氯气中混有少量氯化氢气体时,可以用饱和食盐水除去。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | B | B | A | A | D | C | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | BD | A | CD | D | C | AB | A | D | B |
19.(1) 用塑料袋包裹试剂瓶,把试剂瓶放入盛温水(50℃左右)中,待冰醋酸熔化后,将液状醋酸倒出。
(3分)(2)AD (4分) 本小题共7分
20. (1) f e d c (2分) (2) 块状石灰石;饱和碳酸氢钠溶液, (2分)
CaO+ NH3·H2O ==Ca(OH)2+ NH3↑ (2分)
(3)B (1分) (4) 防倒吸(1分);CO2 +NH3+H2O+NaCl ==NaHCO3↓+NH4Cl(2分)
(5) 过滤(1分); 取少量固体放入试管中, 加入固体大部分消失, 在试管口又较多的固体凝聚。(2分) 本小题共13分
21.(1) NH4Cl, ① (2) NH4Cl、NH3·H2O; NH4Cl、HCl (3) 小于, 大于。 每小题2分共8分
22. (1)H2(2分)
(2)第二 IVA H:C∷C:H(4分)
|
|
(3)
H2O+C CO+H2(2分) 3Fe+4H2O Fe3O4+4H2↑(2分)
Fe+NO3-+4H+==Fe3++NO↑+2 H2O (2分) 本小题共12分
23.(1)C24H12 (2) 胶体 (3) 51:50( 每空2分)
(4) ![]() —CH=CH2+Br2→
—CH=CH2+Br2→![]() —CHBrCH2Br (2分)
—CHBrCH2Br (2分)
醇
![]() —CHBrCH2Br+2NaOH →
—CHBrCH2Br+2NaOH → ![]() —C≡CH+2NaBr+2H2O(2分) 本小题共10分
—C≡CH+2NaBr+2H2O(2分) 本小题共10分
24.①由A两步氧化刻C和A与CO反应生成乙酸, 可确定A是甲醇: CH3OH(2分);由C+H→甲酸丁酯, 可确定H是丁醇: CH3CH2CH2CH2OH(2分);同系物(1分)。
②D与 CH3COOH互为同分异构体且易溶于水, 应是HOCH2CHO,
|
![]() HOCH2CHO +2Cu(OH)2 HOCH2COOH+Cu2O+
2H2O(2分)
HOCH2CHO +2Cu(OH)2 HOCH2COOH+Cu2O+
2H2O(2分)
|
![]() HOCH2CH2OH +CH3COOH CH3COOCH2CH2OOCCH3
+2H2O(2分)
HOCH2CH2OH +CH3COOH CH3COOCH2CH2OOCCH3
+2H2O(2分)
本小题共9分
25. 解:根据有关化学方程式得:
IO3- ~ 6S2O32- (3分)
n(IO3-)=0.03mol/L×18×10-3L÷6=9×10-5mol
m( KIO3)= 9×10-5mol×214g/mol=19.26mg(3分)
每千克食盐含KIO319.26mg÷0.428=45mg>40 mg(3分)
该食盐合格(3分) 本小题共9分
26. 解:
(1) c(NaCl)= =5.3mol·L-1(3分)
c(HCl)= =12 mol·L-1(3分)
(2)因为5.3mol·L-1<12 mol·L-1,所以HCl可以在NaCl溶液中溶解而除去; (2分)
对Cl2来讲, ![]() Cl2反应 Cl2+H2O=HCl+HClO
Cl2反应 Cl2+H2O=HCl+HClO
生成的c(Cl-)= =0.034 mol·L-1><5.3mol·L-1
所以Cl2在NaCl溶液中不溶解,即在饱和NaCl溶液中可以除去HCl而不能除去Cl2
(2分) 本小题共10分