高三化学图表题的解法
用图表表述化学过程或呈现背景信息是化学的基本表达方式,简约化是理科考生应该具有的最基本的思维特征,而图表正是化繁为简的妙法。因此在平时的化学学习中我们应自觉地去了解图表所呈的化学含义,掌握化学图表最基本的分析剖析方法,从中提炼出相关的化学信息,尝试应用图表分析解决化学问题,表述自己的思路与思维的结果。这样不仅可以提高自己的识表识图能力,更能通过这个过程训练与优化自己的思维策略。
有关图、表的化学试题选编
化学反应计算部分
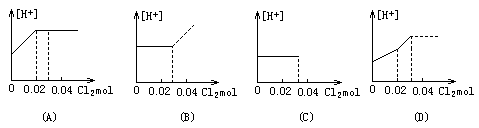
1.将0.03molCl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变)[ ]
2. 将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是[ ]
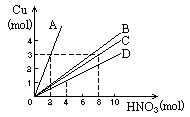 3. 如图表示Cu与稀HNO3反应的量的关系,问哪一条线表示Cu与稀HNO3反应中被还原的硝酸与Cu的量的关系:[ ]
3. 如图表示Cu与稀HNO3反应的量的关系,问哪一条线表示Cu与稀HNO3反应中被还原的硝酸与Cu的量的关系:[ ]
4. 向含3mol Ca(OH)2的石灰水中逐滴加入H3PO4溶液至不再发生反应为止,所得盐的物质的量(纵坐标y)与加入H3PO4物质的量(横坐标x)的关系图是
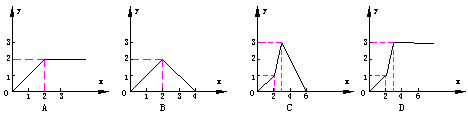 |
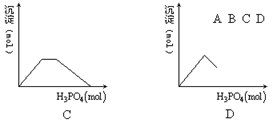
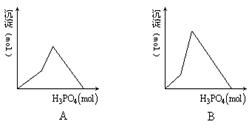 5、往澄清石灰水中加入磷酸,生成的沉淀与加入的磷酸物质的量关系图正确的是[ ]
5、往澄清石灰水中加入磷酸,生成的沉淀与加入的磷酸物质的量关系图正确的是[ ]
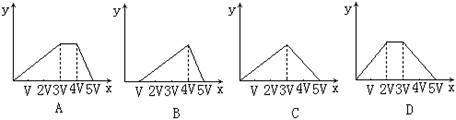
5 向1.0mol/L的甲溶液中逐滴加入1.0mol/L的乙溶液,产生Al(OH)3沉淀的质量(用y轴表示)与所加入乙溶液的体积(用x轴表示)的关系如下图所示.符合图中关系的是下列各组溶液中的
|
|
| (A) | (B) | (C) | (D) |
| 甲 | AlCl3 | NaOH | NaAlO2 | HCl | |
| 乙 | NaOH | AlCl3 | HCl | NaAlO2 |
答案:1A 2B 3A 4D 5B 6B
物质结构部分
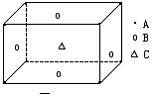 1.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 [ ]
1.某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 [ ]
A.1∶3∶1
B.2∶3∶1
C.2∶2∶1
D.1∶3∶3
2.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( ):
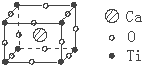
A.Ca4TiO3 B.Ca4TiO6
C.CaTiO3 D.Ca8TiO12
3.石墨晶体如图10-1所示,每一层由无数个正六边形构成,则平均每个正六边形成占有的碳原子数[ ]
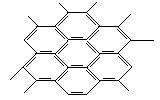
A.6个
B.4个
C.3个
D.2个
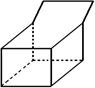
4.蓝烷分子的化学式为C10H12,其结构简式如右图所示,则其二氯取代物的种数为
A 19 B 20 C 21 D 22
 5.已知[Co(NH3)6]3+的主体结构如右图。其中小圆圈表示氨分子,且各相邻的氨分子之间的距离相等。Co3+以位于八面体中心的黑点表示。若其中2个氨分子被Cl-取代,所形成的[Co(NH3)4Cl2]
+及4个氨分子被Cl-取代,所形成的[Co(NH3)2Cl4]-的同分异构体的种数分别为
5.已知[Co(NH3)6]3+的主体结构如右图。其中小圆圈表示氨分子,且各相邻的氨分子之间的距离相等。Co3+以位于八面体中心的黑点表示。若其中2个氨分子被Cl-取代,所形成的[Co(NH3)4Cl2]
+及4个氨分子被Cl-取代,所形成的[Co(NH3)2Cl4]-的同分异构体的种数分别为
(A). 4种和6种 (B). 都是2种
(C). 都是3种 (D). 2种和4种
答案1.A 2.C 3D 4.A 5.B
化学反应速率和化学平衡部分
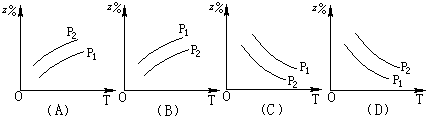
1.在一定温度时,向密闭容器中注入一定量的SO2和O2,引发反应达到平衡时,测得容器内压强为原来的![]() ,则各物质的物质的量(m mol)与反应时间(t min)的关系图中正确的是
,则各物质的物质的量(m mol)与反应时间(t min)的关系图中正确的是
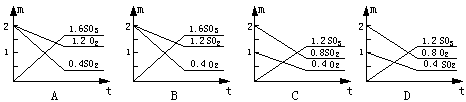 |
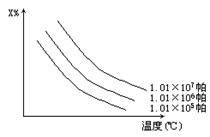 2.在图中x%为气态反应物在平衡体系中的质量分数,该图表示x%、同温度、压强的关系,符合曲线反应的是[ ]
2.在图中x%为气态反应物在平衡体系中的质量分数,该图表示x%、同温度、压强的关系,符合曲线反应的是[ ]
A.2NH3(气)![]() N2(气)+3H2-Q
N2(气)+3H2-Q
B.H2(气)+I2(气)![]() 2HI(气)+Q
2HI(气)+Q
C.4NH3(气)+3O2(气)![]() 2N2(气)+6H2O(气)+Q
2N2(气)+6H2O(气)+Q
D.C(固)+H2O(气)![]() H2(气)+CO(气)-Q
H2(气)+CO(气)-Q
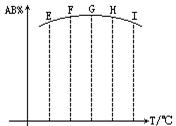 3.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下任其发生反应:A2(g)+2B2(g)2
3.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下任其发生反应:A2(g)+2B2(g)2![]() AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成下图,不正确的叙述是[ ]
AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成下图,不正确的叙述是[ ]
A.反应是放热反应
B.E、F二点尚未达到平衡状态
C.H、I二点尚未达到平衡状态
D.G、H、I三点功能已达平衡状态
4.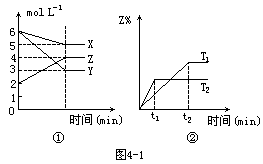 符合图4-1的反应是(T1、T2表示不同的温度)[ ]
符合图4-1的反应是(T1、T2表示不同的温度)[ ]
A.X+3Y![]() 2Z-Q
2Z-Q
B.X+3Y![]() 2Z+Q
2Z+Q
C.X+2Y![]() 3Z+Q
3Z+Q
D.5X+3Y![]() 4Z+Q
4Z+Q
5.在温度相同,压强分别为p1和p2的条件下,发生反应:
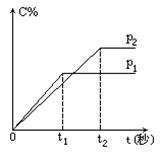 A(气)+2B(气)
A(气)+2B(气)![]() nC(气)
nC(气)
式中C的百分含量与时间t的曲线如图所示。下面的结论正确的是[ ]
A.p1>p2 n<3
B.p1<p2 n>3
C.p1<p2 n=3
D.p1>p2 n>3
![]() 6、右图表示外界条件(温度、压强)的变化对下列反应影响L(固)+G(气) 2R(气)-热,在图中,Y轴是指( )
6、右图表示外界条件(温度、压强)的变化对下列反应影响L(固)+G(气) 2R(气)-热,在图中,Y轴是指( )
A、 平衡混和气中R的百分含量
B、平衡时混和气中G的百分含量
B、 G的转化率
D、L的转化率
 |
7、如图所示,反应:X(气)+3Y(气)
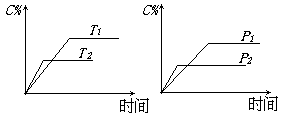
8、.可逆反应mA(固)+nB(气)![]() eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:
下列叙述正确的是( )。
(A)达平衡后,加入催化剂则C%增大
(B)达平衡后,若升温,平衡左移
(C)化学方程式中n>e+f
(D)达平衡后,增加A的量有利于平衡向右移动
 9
9
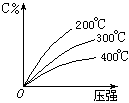 . 反应aA(g)+b(B)(g)
. 反应aA(g)+b(B)(g)
![]() c(C)(g)+Q,生成物C的质量分数与压强P和温度的关系如图,方程式中的系数和Q值符合图象的是( )
c(C)(g)+Q,生成物C的质量分数与压强P和温度的关系如图,方程式中的系数和Q值符合图象的是( )
(A)a+b>c Q>0 (B)a+b>c Q<0
(C)a+b<c Q<0 (D)a+b=c Q>0
 1
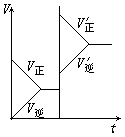
1![]() 0、对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是( )。
0、对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是( )。
(A)Z,W为气体,X,Y中之一为气体
(B)Z,W中之一为气体,X,Y为非气体
(C)X,Y,Z皆为气体,W为非气体
(D)X,Y为气体,Z,W中之一为气体
|
11.在密闭容器中进行下列反应:M(气)+N(气)![]() R(气)+2L
R(气)+2L
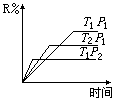 此反应符合下面图像,下列叙述是正确的是( )
此反应符合下面图像,下列叙述是正确的是( )
(A) 正反应吸热,L是气体
(B) 正反应吸热,L是固体
(C) 正反应放热,L是气体
(D) 正反应放热,L是固体或液体
12. 图中C%表示某反应物在体系中的百分含量,v表示反应速度,P表示压强,t表示反应时间。图(A)为温度一定时压强与反应速度的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
(A)4NH3(气)+5O2(气)![]() 4NO(气)+6H2O(气)+808.7kJ
4NO(气)+6H2O(气)+808.7kJ
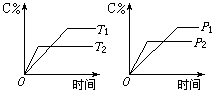 (B)N2O3(气)
(B)N2O3(气)![]() NO2(气)+NO(气)-41.8kJ
NO2(气)+NO(气)-41.8kJ
(C)3NO2(气)+H2O(液)![]() 2HNO3(液)+NO(气)+261.3kJ
2HNO3(液)+NO(气)+261.3kJ
(D)CO2(气)+C(固)![]() 2CO(气)-171.4kJ
2CO(气)-171.4kJ
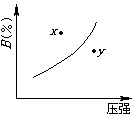
![]() 13.对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
13.对于mA(固)+nB(气) pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
(A)m+n<p
(B)n>p
 (C)x点的状态是v正>v逆
(C)x点的状态是v正>v逆
(D)x点比y点的反应速度慢
14.由可逆反应测绘出图像,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
(A)反应物中一定有气体
(B)生成物中一定有气体
(C)正反应一定是放热反应
(D)正反应一定是吸热反应
15. 在一定条件下,反应A(气)+B(气)![]() C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断
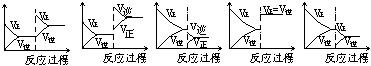
A. B. C. D. E.
(1)升温,达到新的平衡的是( )
(2)降压,达到新的平衡的是( )
(3)减少C的量,移向新平衡的是( )
(4)增加A的量,移向新平衡的是( )
(5)使用催化剂,达到平衡的是( )
答案:1AC 2AC 3C 4B 5A 6B 7.C 8.C 9.A 10D 11.C 12.BD 13.BC 14.AD 15(1)B(2) C (3)E (4)A (5)D
电解质溶液部分
1.常温时,pH=1的两种一元酸溶液A和B,分别加水稀释1000倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正确的是 [A、D]
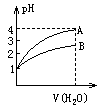
A.B酸比A酸的电离度小
B.B酸比A酸容易电离
C.B是弱酸,A是强酸
D.pH=1时,B酸的物质的量浓度比A酸大
2.25℃时将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的是
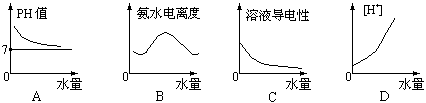
3.在AgNO3溶液中插入一对连接有电阻测量仪的电极,在搅拌下滴加浓氨水,随着氨水的加入(忽略稀释效应),电阻R变化的曲线图中正确的是
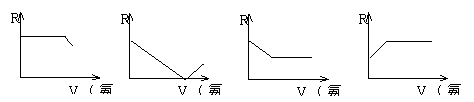
![]()
A B C D
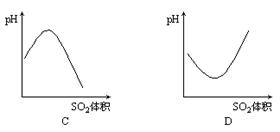
4.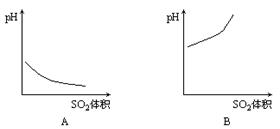 下图是表示在室温下,向饱和的H2S溶液中缓慢通入SO2气体直至过量,溶液的pH值随通入SO2气体体积变化的曲线,合理的是[ ]
下图是表示在室温下,向饱和的H2S溶液中缓慢通入SO2气体直至过量,溶液的pH值随通入SO2气体体积变化的曲线,合理的是[ ]
答案:1AD 2AC 3B 4B
原电池与电解池部分
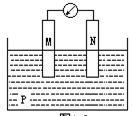
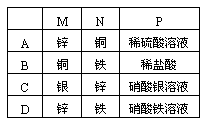
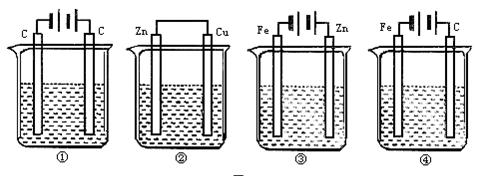
1.如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是[ ]
2.如下图,当阴极增重2.16g时,下列判断正确的是[ ]
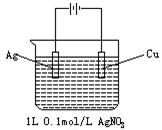
A.[AgNO3]=0.08mol/L
B.阳极产生112mL气体(标况)
C.有1.204×1023个电子转移
D.反应中有0.02mol物质被氧化
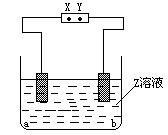
3.下图中X、Y分别是直流电源的两极,通电后发现a极极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是[ ]
4.下图中 4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/ LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液工作一段时间后,测得导线上均通过了0.002 mol电子,此时溶液的 pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)[ ]
A.④②③①
B.④③①②
C.④③②①
D.④①③②</PGN0015B.TXT/PGN>
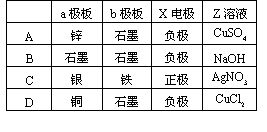
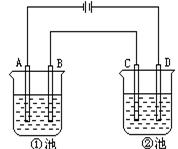
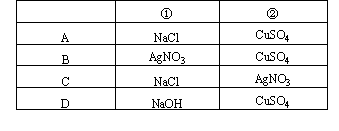
5.如图实验装置,若要求通直流电一段时间后①池的pH值上升,②池的pH值下降,且B、C两极放电的离子的物质的量相等,则电解池应选用下表中哪组电解池[ ]
答案:1C 2D 3AD 4C 5C
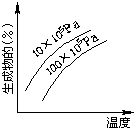
其它类
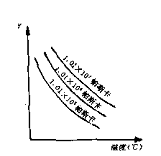
1. A、B两种物质的饱和溶液的百分比浓度随温度变化的曲线如图:现分别在50gA和80gB中各加水150g,加热溶解后并都蒸发水50g,冷却到t1℃,下列叙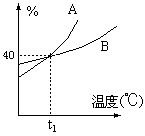 述正确的是( )
述正确的是( )
A. t1℃A、B溶液的溶质质量分数相等
B. t1℃时溶液中A的浓度小于B的浓度
C. t1℃时两者均无固体析出
D. t1℃时析出固体B
〖提示〗:纵坐标是百分比浓度。
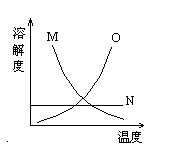 2. 化合物M(见右图)可能是[ ]
2. 化合物M(见右图)可能是[ ]
A.一种难溶的物质
B.一种不溶于水的液体
C.一种气体
D.硝酸钾
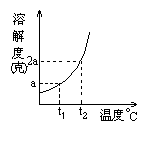 3.
3.![]()
数为[ ]
![]()
![]()
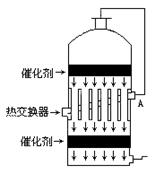 4.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)按此密闭体系中气体的流向,则在A处流出的气体为 [
]
4.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)按此密闭体系中气体的流向,则在A处流出的气体为 [
]
A.SO2
B.SO3,O2
C.SO2,O2
D.SO2,SO3
答案:1BC 2A 3A 4A