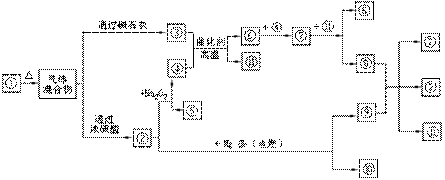高三化学无机推断与框图题
化学推断题是需要通过合乎逻辑的严密推理,得出正确结论的习题。它可以以文字的形式表述,一般题目都比较长,信息量比较大,涉及的知识面比较广,综合性比较强,在高考中能很好地检测学生的知识和能力储备;也可以以框图的形式表述,框图题是推断题的一种表现形式,是对常见元素的单质及化合物相互关系的综合考查,是浓缩了的元素及其化合物的信息图。框图题由于题目字数少,题意及所供信息新而简洁,且比较抽象,学生往往无从下手,也有一定的难度。化学推断题不仅能考查学生掌握和运用双基知识的能力,还能更有效地考查学生的阅读能力、思维能力和综合应用能力,因而成了高考中的一种十分重要的命题形式。能否解框图题是能否取得理想化学成绩的重要一环。高考时,要想在规定时间和紧张的气氛中,顺利做好这类试题,除要有扎实的基础知识以外,还要了解推断题的一般解题方法,掌握一定的解题技巧。
一、推断题的求解步骤
(1) 读审 仔细读题,审清题意。读题,包括阅读求解要求。求解要求,往往亦能给考生以重要的启示,这点不能忽视。“读审”是解题的基础。
(2) 找析 找准“题眼”,即找准解题的突破口然后联系新信息及所学旧知识,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式,进行综合分析推理。“找析”是解题的关键。
(3) 解答 看清要求,认真解答。“解答”是解题的落脚点。
二、寻求解题“突破口”的途径
找到解题的突破口,便是解题成功的一半。可从下列途径去找突破口。
(1)从物质的组成结构方面寻找
例如,具有正四面体结构的物质可能为甲烷或白磷或铵根离子;不含金属元素的离子化合物为铵盐等。
(2)从实验现象寻找
例如,向一溶液中滴入碱液,先产生白色沉淀,进而变成灰绿色,最后变成红褐色沉淀,则该溶液中一定含Fe2+;遇空气迅速由无色变为红棕色的气体必为NO,等等。
(3)从反应类型寻找
例如,同一元素的气态氢化物和气态氧化物反应生成该元素的单质和水,则该元素可能为S或N;能“三合一”的反应:NH3、H2O、CO2或氢氧化亚铁、水、氧气或NO2、O2、H2O;对不常见的反应,亦必须加以注意。
(4)从典型性质寻找
例如,密度最小的气体为H2;地壳中含量最多的元素为O,最多的金属元素为Al;溶解SiO2的酸为HF;遇苯酚生成紫色溶液的离子为Fe3+,等等。
(5)从反应条件控制
如必须控制170oC的反应比是制取乙烯的反应;必须在沸水浴中用浓盐酸作催化剂的反应必为制酚醛树脂的反应等。
(6)从数据去寻找
根据计算或题给信息,可获得某些数据,这些数据也可使我们找到突破口。如物质的熔点较低,说明为分子晶体;反之,亦可能为原子晶体。
请记好下列常用的知识规律,对解推断题会有较大帮助。
(1) 具有特征性质的物质归类
① 同一元素的气态氢化物与气态氧化物反应,生成该元素的单质与水,元素可能是硫或氮。
② 同一元素的气态氢化物与与最高价氧化物对应的水化物化合生成盐的元素一定是氮。
③ 两溶液反应生成沉淀和气体,这两种溶液的溶质分别为:a.氢氧化钡与硫酸铵。b.可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐。C.可溶性铁盐与可溶性碳酸盐或碳酸氢盐。d.硫代硫酸盐与强酸。
④ 既能与酸反应,又能与碱反应物质可能是Al、Al2O3、Al(OH)3、、氨基酸、弱酸的铵盐、弱酸的酸式盐等。
⑤ 既能与强酸反应放出气体又能与强碱反应放出气体,常见的物质有:Al、弱酸的铵盐[(NH4)2CO3、NH4HCO3、(NH4)2SO3、NH4HSO3、(NH4)2S、NH4HS等。
⑥ 在水中分解生成气体和难溶物或微溶物的物质可能是Al2S3、Mg3N2、CaC2等。
⑦ 与水接触放出气体的常见物质有:Li、Na、K、Na2O2、F2等。
⑧ A物质加到B物质中,先生成沉淀,后沉淀又溶解,A和B可能分别是CO2和Ca(OH)2、NaOH与铝盐、NH3与AgNO3溶液、HCl与NaAlO2、稀盐酸与Fe(OH)3胶体等。
⑨ 使溴水褪色的物质有:硫化氢、二氧化硫、不饱和烃类、活泼金属碱类等。
(2) 特征的实验现象
① H2在Cl2中燃烧呈苍白色火焰。在氯掘中燃烧生成魄烟雾的是磷。钠元素焰色反应为黄色,钾元素焰色反应为紫色。在空气中迅速由无色变为红棕色的气体是NO等。
② 遇酚酞变红的气体必为氨气。
③ 向一溶液中加入碱液,产生白色沉淀,进而变成灰绿色,最后变成红棕色,该溶液中必含有Fe2+。遇SCN-显红色或遇OH-生成红褐色沉淀或遇苯酚显紫色的离子是Fe3+。
④ 遇BaCl2生成生成不溶于稀硝酸的白色沉淀的溶液可能溶有SO42-或Ag+。遇HCl生成沉淀的溶液中可能含有Ag+、Si2O32-、S2O32-。
⑤ 具有臭鸡蛋气味的气体是H2S,与H2S反应生成淡黄色沉淀的气体可能是Cl2、O2、SO2、NO2等.
⑥ 电解电解质溶液时阳极气态产物一般是氯气和氧气,阴极气态产物是氢气。
⑦ 使品红褪色的气体可能是Cl2或SO2,物质可能是次氯酸钠、次氯酸钙、氯水、过氧化钠等。
(3) 特殊的转化关系
① 金属→碱性氧化物→碱→盐;
非金属→酸性氧化物→酸→盐。
② 交叉型转化关系
③ 三角形转化关系
Fe、Fe2+、Fe3+;S、H2S、S2-;Al、Al3+、AlO2-;烯、醇、卤代烃。
三、典型例题解析
[例1] A、B、C、D、E五种主族元素,位于周期表的前四周期,且原子序数依次递增,A、C两元素的电子层数相同,A、E两元素的最外层和次外层电子数相同,A和C形成化合AC,D和E形成化合物ED2,B元素的单质能从酸中置换出其1.5mol氢气。
(1)写出这五种元素的名称和符号;
(2)写出AC和ED2的电子式;
(3)写出这五种元素最高氧化物的水化物的分子式,分析其酸性变化情况;
(4)写出能形成气态氢化物的分子式,并比较其稳定性及水溶液导电的情况;
(5)B和D形成的白色固体,在1800C时升华,能溶于有机溶剂,试判断它是什么晶体?从蒸气密度测定表明,它具有双分子缔合结构,说明在两个单分子间通过什么键结合?试写出这种双分子的结构式。
[解析] 据题意,A、C同周期(因为相同的电子层数),A、E同主族(次外层和最外层电子数相同)。
据A+C→AC,有两种可能:A为ⅠA,C为ⅦA,或A为ⅡA族,C为ⅥA族;据D+E→ED2,可推测E为ⅡA族或ⅣA。综合以上情况,A、E应为ⅡA族元素,可推知C为ⅥA族,D为ⅦA族;因为A、B、C原子序数依次递增,所以B在A、C中间,且B元素在与酸反应中呈+3价,则B一定与A、C同周期,为ⅢA族元素。
又因为A、E次外层和最外层电子数相同,所以A、E不可能是2、3周期,而只可能是3、4周期。由此可得出A是镁,E是钙,并可推出B是铝,C是硫,D是氯。元素一经推出,其他问题便可迎刃而解。
所以本题的正确答案是:
(1)A是镁,Mg;B是铝,Al;C是硫,S;D是氯,Cl;E是钙,Ca。
(2)AC: ![]() 、ED2:
、ED2:![]()
(3)![]()
(4)H2S、HCl;稳定性:HCl>H2S;水溶液的导电性HCl溶液比H2S溶液强。
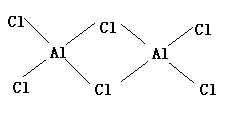
(5)B与D形成AlCl3,它是分子晶体。由于AlCl3分子中Al原子有空轨道,Cl原子有孤对电子,因此两个AlCl3分子可通过配位键形成双分子缔合结构。其结构式为:
[例2]今有A、B、C、D、E五种溶液,溶质所电离出来的阴、阳离子分别是以下两组离子中的各一种,每种离子都不重复。
阳离子是:Na+、Al3+、Ba2+、Ag+、NH4+;阴离子是:Cl-、OH-、CO32-、NO3-、
SO42-。取溶液进行如下实验:
1、A+B:产生白色沉淀,沉淀不溶于稀硝酸。
2、B+C:产生白色沉淀和无色无味气体。
3、C+D:产生白色沉淀,沉淀可溶于稀硝酸。
4、D+E:产生白色沉淀和刺激性气味气体,沉淀不溶于稀硝酸。
试根据上述实验现象推断A、B、C、D、E的化学式,写出各步反应的离子方程式。
[解析]本题有一定难度,若阴、阳离子逐个组合、验证,最终也能得出结论,但绝不可取,必须全面分析,兵分六路率先突破。实验1、4都生成不溶于稀硝酸的白色沉淀,这两种沉淀不外乎是AgCl和BaSO4,D与E反应还生成刺激性气味的气体,显然是氨气,若沉淀是AgCl,则可溶性银盐只能是AgNO3,那么另一种就是NH4Cl,但AgNO3与NH4Cl反应不可能有氨气逸出,因此,实验1、4生成的沉淀分别只能是AgCl和BaSO4。
进一步推出,A、B中须有一种是AgNO3,另一种是氯化物;D、E中必有一种是(NH4)2SO4,根据阴离子组合,另一种只能是Ba(OH)2,且D不可能是(NH4)2SO4,因为找不到另一种金属离子(Ag+离子已排除)与SO42-离子结合生成不溶于稀硝酸的白色沉淀。因此,D只能是Ba(OH)2,E是(NH4)2SO4。余下的推断就不难进行了。
故本题的正确答案是:A是AgNO3,B是AlCl3,C是Na2CO3,D是Ba(OH)2,E是(NH4)2SO4。上述各步反应的离子方程式为:
1、Ag++Cl-=AgCl↓;
2、2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
3、Ba2++CO32-=BaCO3↓, BaCO3+2H+=Ba2++CO2↑+H2O;
4、2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3↑+2H2O。
[例3]A,B,C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质。这些化合物和单质之间存在如图1所示的关系。
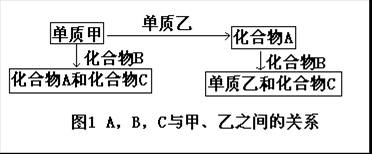
由此判断:
(1)在A,B,C三种化合物中,必定含有乙元素的是_________(用A,B,C字母填写)。
(2)单质乙必定是________(填“金属”或“非金属”),其理由是________。
(3)单质乙的分子式可能是_________。则化合物B的分子式是___________。
[解析]本题主要考查思维能力,包括逻辑思维和发散思维的能力等。
(1)题中指出,A,B,C都是由两种元素组成的化合物,因此由:单质甲+单质乙→化合物A,可知化合物A中肯定含有乙元素。由:单质甲+化合物B→化合物A+化合物C,可知化合物B中也肯定含有乙元素(因为化合物A中的乙元素只能来自化合物B)。
但是化合物C中是否含有乙元素则是不能确定的,我们从2H2S+SO2=3S↓+2H2O的反应中可以看出化合物C中不含乙元素,我们从PbO2+H2O2=O2↑+PbO+H2O的反应中可以看出,反应的两种生成物中仍含有氧元素。所以(1)小题的答案为A,B。
(2)我们知道,金属元素在化合物中只显正价,而非金属元素在化合物中可显正价也可显负价。在反应化合物A+化合物B→单质乙+化合物C中,由于A,B都含有乙元素,反应之后有单质乙生成。这说明A,B两种化合物中必有一种乙元素显正价,另一种乙元素显负价。如果两种化合物中乙元素都显正价或负价,则不可能反应生成显零价的单质。所以(2)小题的答案是:乙必定是非金属。
(4) 回答本小题要求元素及其化合物知识十分熟悉,而且要习惯于发散思维,要注意寻找发散思维的出发点。本题中就应该从两种含有相同元素的化合物(其中一个该元素显正价,另一个显负价)发生反歧化反应,生成该元素单质作为思维的出发点,立足于这一点就可能想到反应:2H2S+SO2=3S↓+2H2O。
还可能想成:4NH3+6NO
![]() 5N2+6H2O,将这几种物质放到所给出的反应关系中去试验,就可得出(3)小题的答案为单质甲可能是O2,单质乙可能是S(或N2);A可能是SO2(或NO);B可能是H2S(或NH3);C则是H2O。
5N2+6H2O,将这几种物质放到所给出的反应关系中去试验,就可得出(3)小题的答案为单质甲可能是O2,单质乙可能是S(或N2);A可能是SO2(或NO);B可能是H2S(或NH3);C则是H2O。
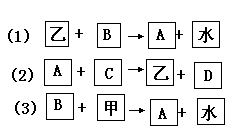 [例4]今有甲、乙两种固体物质,已知其中之一为氧化镁;另有A、B、C、D 4种无色溶液分别为氢氧化钠溶液、硝酸镁溶液、硝酸钠溶液和稀硝酸中的某一种,它们之间的相互关系如图表示:
[例4]今有甲、乙两种固体物质,已知其中之一为氧化镁;另有A、B、C、D 4种无色溶液分别为氢氧化钠溶液、硝酸镁溶液、硝酸钠溶液和稀硝酸中的某一种,它们之间的相互关系如图表示:
试判断:A、B、C、D各是什么溶液(用化学式表示)?甲、乙各是什么物质?
[解析]本题6种物质的名称均未确定,且甲、乙均可能为MgO,不妨设甲为MgO,参照试题提供的反应线索论证,可使此题错综复杂的关系变得明朗,从而使各物名称逐一确定。若甲为MgO,则甲与B反应生成A和H2O,可推知A是Mg(NO3)2,B是稀硝酸(因MgO是碱性氧化物,与硝酸反应生成硝酸盐和水)。然后,以B(HNO3)这个已确定物质为起点,结合(1)并知A为Mg(NO3)2,运用反应规律推知乙为Mg(OH)2。C不可能为MgO,因已假定甲为MgO,由于A、乙名称已确定,结合(2)和无机物相互反应规律,不难推知C必为NaOH,D为NaNO3了。
当然,也可假定乙为MgO,但在按上述框图推新时,会产生假设与反应事实相矛盾的结果,故乙为MgO的假设不成立。 所以本题的正确答案是:A是Mg(NO3)2溶液,B是HNO3,CNaOH溶液,D是NaNO3溶液,甲为MgO,乙为Mg(OH)2。
[例5]从某物质A的水溶液出发,有下图所示的一系列变化(参加反应或反应生成的水没有标出)。
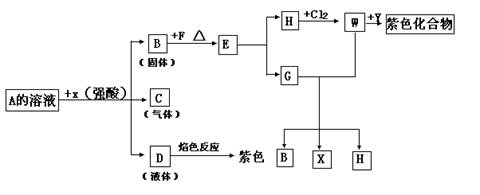
(1)写出下列物质的名称:H___________,G__________,W___________。
(2)写出A+X→B+C+D的化学方程式_____________。
(3)写出G+W→B+X+H的化学方程式_____________。
[解析]此题涉及无机、有机化学多方面的知识点,它是突破口极为隐蔽也极易出错的难度较大的综合推断题。乍看此题,有两个切入口:①焰色反应D为紫色(含K+),
②W+Y→紫色化合物(含苯酚络离子[Fe(C6H5O)6]3-)逆向追踪,A可能为钾盐,是什么钾盐,茫茫然难以确定。若假设为KHSO3和KHCO3,而加X(强酸)生成产物分别为固、液、气三态的B、C、D,不可能(与反应事实不符)。满足此条件的化合物A必为K2S2O3,与强酸反应生成物;S(固态)、SO2(气体)、KCl+H2O(液体)。但B(硫)![]() E,无法确定,至此,正向思维的线
E,无法确定,至此,正向思维的线
索中断。此时应倒过来思考:以紫色化合物为起点倒推W是什么。在中学化学中紫色化合物只有三价铁的苯酚络离子[Fe(C6H5O)6]3-,故推断W为Fe3+,Y则为![]() 。继而逆推H为Fe2+,联系B→E的变化,E只能是FeS,才可能是FeS+2HCl=FeCl2+H2S↑,故H为FeCl2,2FeCl2+Cl2=2FeCl3(W)。解答本题的关键在于选准A和紫色化合物两个题眼(突破口)运用正、逆向思维和“两头堵”——双向进逼的方法破译如此极为隐蔽的“密码”。解码的武器是掌握硫、铁两章知识网络、有关络合物知识,培养统摄知识的能力。
。继而逆推H为Fe2+,联系B→E的变化,E只能是FeS,才可能是FeS+2HCl=FeCl2+H2S↑,故H为FeCl2,2FeCl2+Cl2=2FeCl3(W)。解答本题的关键在于选准A和紫色化合物两个题眼(突破口)运用正、逆向思维和“两头堵”——双向进逼的方法破译如此极为隐蔽的“密码”。解码的武器是掌握硫、铁两章知识网络、有关络合物知识,培养统摄知识的能力。
所以本题的正确答案为:(1)H:Fe2+ ,G:H2S,W:FeCl3。
(2)Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O
(3)H2S+2FeCl3=S↓+2HCl+2FeCl2
附:近几年高考推断及框图题
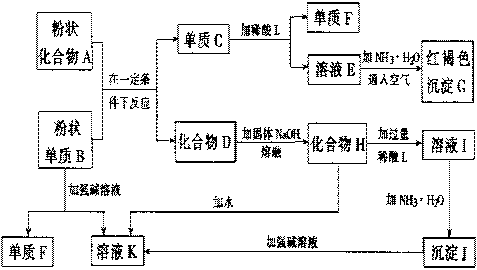
99’.(8分〕提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
|
|
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离于是_____________________。
(4)由CEF若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
答案:(1)H2
(2)4Fe2++8NH3·H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Al3+和Na+
(4)H2SO4(或HNO3) (每空2分,共8分)
(2000’天津江西卷--25)(9分)下图每一方框中的字母代表一种反应物或生成物:
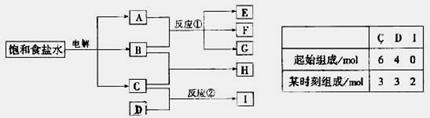
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1) 物质H的分子式是___________。
(2) 反应①的化学方程式是________________________。
(3) 反应②的化学方程式(须注明反应条件)是_______________。
答案:(1)HCl (2分)
(2)Cl2+2NaOHNaCl+NaClO+H2O (2分)
(3)N2+3H2 ![]() 2NH3(化学方程式3分,反应条件2分)
2NH3(化学方程式3分,反应条件2分)
21.(10分)在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比![]()
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是___________,单质Z是___________(填写名称或分子式)。
(2)Y分子中共含___________个共价键。
(3)X分解为Y和Z的化学方程式为:______________________。
答案:(1)白磷(或![]() ),氢(或
),氢(或![]() (3分)
(3分)
(2)6 (3分)
(3)![]() (4分)
(4分)
(6分)若以X、Y和Z代表三种元素,且知X与Y可形成原子数之比为1︰1的化合物甲,Y与Z也可形成原子数之比为1︰1的化合物乙,又知甲分子含18个电子,乙分子含38个电子,请填空:
(1)元素Y在第 周期。
(2)化合物甲的分子式是 。
(3)化合物乙的分子式是 。
答案:(6分)
(1) 第二周期(2)H2O2(3)Na2O2
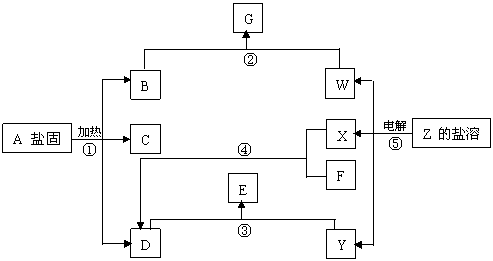 (11分)
(11分)
在一定条件下(不许添加别的反应物),经不同的化学反应,可实现如上图的各种变化。其中,反应③、④、⑤属氧化还原反应,而反应①、②属非氧化还原反应。X、F和Y为单质,且F是空气的主要成分之一,其余为化合物,据此请填空:
(1)物质A是 ,F是 ,X是 ,Y是 。
(2)写出反应②的化学方程式 。
(3)写出反应④的化学方程式 。
答案:(11分)
(1)A是(NH4)2CO3(或NH4HCO3),F是N2,X是H2,Y是Cl2。
 (2)CO2+2NaOH=Na2CO3+H2O(或CO2+NaOH=NaHCO3)
(2)CO2+2NaOH=Na2CO3+H2O(或CO2+NaOH=NaHCO3)
 |
(3)N2+3H2![]() 2NH3
2NH3
10分)
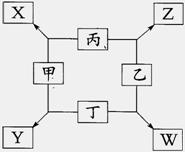
如图所示已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1︰3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1︰2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是 。
(2)甲与丙反应生成X的化学方程式是
(3)乙与丁反应生成W的化学方程式是
利用天然气合成氨的工艺流程示意如下:
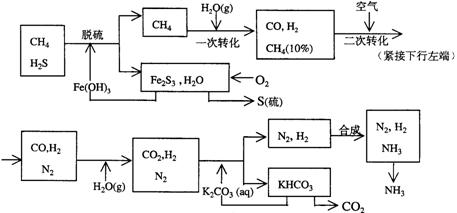
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是
(2)n mol CH4经一次转化后产生CO 0.9n mol、产生H2 mol(用含n的代数式表示)
(3)K2CO3(aq)和 CO2反应在加压下进行,加压的理论依据是 (多选扣分)
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于
(写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
答案:(本题共12分)
(1)3H2S+2Fe(OH)3→Fe2S3+6H2O(2分)
(2)27n(3分)
(3)b(3分)
(4)生产纯碱(或作制冷剂等,其它合理答案也给分)(2分)
(5)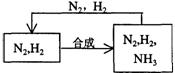 (2分)
(2分)
(12分)室温下,单质A,B,C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按图2进行反应。又知E溶液是无色的,请回答:
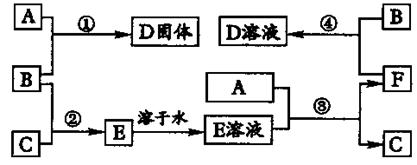
图2 反应流程
(1)A是 、B 是、C是 (请填化学式)。
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的化学方程式为:
。
答案:(1)Fe
Cl2 H2 (2)2Fe+3Cl2![]() 2FeCl3
2FeCl3
(3)2HCl+Fe=FeCl2+H2↑
(4)2FeCl2+Cl2=2FeCl3
(7分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4 种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式: 。
(2)这四种溶液分别是:甲: 、乙: 、丙: 、丁: 。
答案:(1)2H++CO32-=H2O+CO2↑
(2)甲:氯化钙、乙:碳酸钠 、丙:硝酸银、丁:盐酸 (或写化学式)。
(6分)下图中①~⑾分别代表有关反应中的一种物质,请填写以下空白。
(1)①、③、④的化学式分别是_____、_____、_____。
(2)⑧与⑨反应的化学方程式是_____。
答案:(1)NH4HCO3; NH3; O2
(2)C+4HNO3=2H2O+4NO2↑+CO2↑