高三化学期中考试试卷
本试卷分第1卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试用时120分钟。
第I卷(选择题共72分)
可能用到的原子量:H—1 O—16 C—12 S—32 Na—23 K—39 Ag—108 Cl—35.5
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性;②使用时加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。据此可推测其有效成分可能是 ( )
A.Cl2 B.SO2 C.NaClO D.KMnO4
2.氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是 ( )
A.H2 B.HF C.O2 D.OF2
3.硫代硫酸钠是分析化学中常用试剂,已知硫代硫酸钠有下列性质:Na2S2O3+CO2+H2O=NaHCO3+NaHSO3+S↓,2Na2S2O3+O2=2Na2SO4+2S↓,Na2S2O3![]() Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( )
Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂是
( )
A.硫酸 B.亚硫酸钠 C.硫 D.碘化汞(HgI2)
4.下列热化学方程式中的△H能表示可燃物的燃烧热的是 ( )
A.H2(g)+ Cl2(g)= 2HCl(g);△H= —184.6kJ/mol
B.CH4(g)+2O2(g)= CO2(g)+2H2O(g);△H= —802.3 kJ/mol
C.CO(g)+1/2O2(g)= CO2(g);△H= —283 kJ/mol
D.2H2(g)+ O2(g)= 2H2O(l);△H= —571.6 kJ/mol
5.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色会逐渐褪色;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是( )
A.镁粉只直接与溴水中的溴反应
B.镁粉只与溴水中的酸反应
C.镁粉同时与溴水中的溴和酸反应
D.镁粉在水的催化下与溴发生反应
6.等体积、等物质的量浓度的NaCl和NaF溶液,两份溶液中离子总数相比 ( )
A.前者多 B.后者多 C.一样多 D.无法判断
1999年诺贝尔化学奖授予了具有埃及和美国双重国籍的科学家艾哈迈德.泽维尔,以表彰他使“运用激光技术观察化学反应时分子中原子的运动”成为可能。请根据题示信息完成7-8题:
7.泽维尔研究了氰化碘的分解反应2ICN=I2+(CN)2,他发现这个反应是在200飞秒内完成的(飞秒:时间单位,1飞秒=10-15秒)。已知(CN)2的性质和卤素相似,则下列有关ICN的叙述正确的是 ( )
A.ICN的晶体是离子晶体 B.ICN是共价化合物
C.ICN不能与NaOH溶液反应 D.ICN在常温下不可能是固体
8.泽维尔还用激光技术研究了碘化钠的分解:2NaI=2Na+I2,他发现当对碘化纳晶体施以能量脉冲,当Na和I两核距离10~15Å(1 Å =10-10m)呈离子键;两核靠近约2.8 Å时呈共价键。由此可见 ( )
A.NaI 的晶体是离子晶体和原子晶体的化合物
B.Na和I之间既有离子键又有共价键
C.离子键和共价键之间没有明确的界限
D.NaI的熔点比较低
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.设NA表示阿伏加德罗常数,下列说法中不正确的是 ( )
A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,如还原产物为NO,则被还原的氮原子数小于NA
B.1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.常温常压下,NA个臭氧分子的体积大于22.4L
D.1.8gH2O离子中含有的电子总数为NA
10.在一恒温恒容的密闭容器内,放入3.0mol A、4.0mol B,发生如下反应:
3A(g)+4B(g)![]() 2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是 ( )
2C(g)+nD(g)[n可能为3、4、5、6、7、],若平衡时总压比起始时增大20%,则n可能是 ( )
A.3 B.4 C.6 D.7
11.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族。下列推断不正确的是 ( )
A.A、B、E一定在不同周期
B.C的最高价氧化物的水化物可能显碱性
C.A、D可能在同一主族
D.C和D的单质可能化合形成离子化合物
12.下列离子方程式书写正确的是 ( )
A.Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:3Ba2++6OH-+2Al3++3 SO42-=3BaSO4↓+2Al(OH)3↓
B.Cl2通入冷水中:Cl2+H2O=Cl-+ClO-+2H+
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓
D.漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
13.用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻越大,它的电导越小)。如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围的H2S含量,但电导变化不大;若用浓溴水吸收,仅限于测定低浓度范围内H2S的含量,但有很高的灵敏度。现要兼顾吸收容量与灵敏度的情况下测定空气中氯气的含量,则应选用下列吸收剂中的 ( )
A.Na2SO3溶液 B.HI溶液 C.NaOH溶液 D.H2O溶液
14.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为b%;质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a%,而等体积混合后的质量分数为c%。则a、b、c的大小关系正确的是 ( )
A.a>b>c B.b>a>c C.c>a>b D.a>c>b
15.镍-镉可充电电池,电池材料是Cd和NiO(OH),电解质是KOH,电池的总反应式是:Cd+2NiO(OH)+2H2O ![]() 2Ni(OH)2+Cd(OH)2。
2Ni(OH)2+Cd(OH)2。
下列说法不正确的是 ( )
A.放电时,负极的电极反应为:Cd+2OH--2e-=Cd(OH)2
B.电池充电时,镉元素被还原
C.电池放电时,电池负极周围溶液的pH不断增大
D.电池充电时,电池的负极和电源的正极连接
16.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入一气体X仍无沉淀,则X可能是 ( )
A.Cl2 B.NH3 C.NO2 D.CO2
17.将W g NO2充入1L的容器甲中,W g N2O4充入某容器乙中,发生如下反应:2 NO2(g)![]() N2O4(g),在一定温度下,开始时甲、乙体积相等,甲保持恒容而乙保持恒压的情况下,都达到平衡。则下列正确的是
( )
N2O4(g),在一定温度下,开始时甲、乙体积相等,甲保持恒容而乙保持恒压的情况下,都达到平衡。则下列正确的是
( )
A.平衡混合气密度:甲>乙 B.体系颜色无法确定谁深
C.体系颜色乙深 D.NO2的百分含量:甲<乙
18.将0.2mol KMnO4在一定温度下加热后生成a molO2;将剩余固体与过量浓盐酸混合加热又生成b molCl2,此时锰元素全部以Mn2+形式存在。若a+b=m,则m的值可能为 ( )
A.0.35 B.0.45 C.0.55 D.0.60
第Ⅱ卷(非选择题共78分)
三.(本题包括2小题,共18分)
19.(8分)某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种。请你设计实验方案加以鉴别,可不填满,也可增加。
| 方案 | 操作过程 | 现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
20.(10分)为了测定某不溶于水的混合气体的平均相对分子质量(比空气重),设计了下列实验:①取一配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1。
②往锥形瓶中通入干燥的样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到m2。
③往锥形瓶内加满水,塞好瓶塞,得到质量m3。
已知实验时温度为T(K),压强为P(kPa),水的密度为ρ水(g/L),空气的平均相对分子质量为29.0,空气密度为ρ空气(g/L),回答下列问题:
(1)本实验的理论依据是:________________________________________。
(2)步骤②中重复操作至质量相同的原因___________________________。
(3)如何做到每次测量都是在相同体积下进行的?___________________
________________________________________________________________。
(4)本样品收集时,可选用的方法是____________。
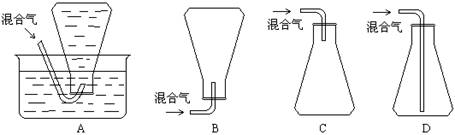
(5)该混合气的平均相对分子质量是:_____________________________。
四.(本题包括2小题,共21分)
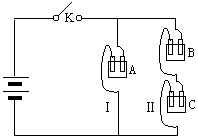 21.(10分)有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按图所示方式在电路中连接。闭合开关K后,测得各支路电流强度IⅠ≈IⅡ
21.(10分)有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按图所示方式在电路中连接。闭合开关K后,测得各支路电流强度IⅠ≈IⅡ
(其中IⅡ略小)。
若撤去B,测知电流强度IA<<IC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过Ⅰ处A、B混合溶液的电流强度的大小关系为:IAB>>IA。
已知A、B、C分别选自下列溶液:①0.1mol/L盐酸②0.1mol/L醋酸③0.1mol/LNaCl溶液④0.1mol/L硫酸⑤0.1mol/LNaOH溶液⑥0.1mol/L氨水,且25℃时,A溶液pH<7。回答下列问题:
(1)指出A、B、C是(或可能是)什么溶液?
A:______________B:______________C:______________
(2)若向C溶液中滴入酚酞试剂呈红色,则C是:___________________,
 将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大?(填A、B、C)_____________。
将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离程度最大?(填A、B、C)_____________。
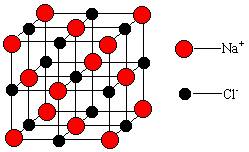
22.(11分)研究离子晶体,常考虑以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中Na+与离它最近的Cl-之间的距离为d,以Na+为球心,则:
(1)第二层球面离子有_______个,离球心离子的距离为_______d,它们是_______(填“钠”或“氯”)离子。
(2)已知在晶体中Na+离子的半径为116pm,Cl-的半径为167pm,它们在晶体中是紧密接触的。则离子占据整个晶体空间的百分数为__________。
(3)纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某NaCl纳米颗粒的大小和形状恰等于NaCl晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为____________。
(4)假设某NaCl颗粒形状为立方体,边长为NaCl晶胞边长的10倍,则表面原子占总原子数的百分数为_________。
五.(本题包括2小题,共21分)
23.(9分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
回答下列问题:
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)______________________________________________。
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能是_______0.11mol/L(填“>”、“=”、“<”)。理由是_________
________________________________________________________________。
(3)NaHA溶液中各离子浓度由大到小的顺序是______________________。
24.(12分)有A、B、C、D四种单质,在一定条件下,A、B、C分别跟D发生化合反应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子),而B跟C发生化合反应生成丁,这些单质和化合物之间的反应有如下关系:
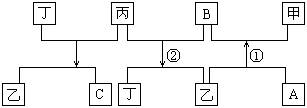
(1)写出下列物质的化学式:甲______,乙______,丙______,丁______。
(2)写出一个与乙分子空间构型相同的物质的名称_______,写出A与镁反应产物的电子式________。
(3)写出反应①②的化学方程式:①_______________________________,②_______________________________。
六.(本题包括2小题,共18分)
25.(8分)t℃下,100.0g某盐溶液中含有溶质29.0g ,将该溶液蒸发掉8.0g水,在恢复到t℃时,从溶液中析出不含结晶水的晶体2.0g。
(1)依题意判断,原溶液是不是饱和溶液?
(2)t℃下,该盐的溶解度是多少?
(3)若向原溶液中添加4.0g溶质,则需要加水多少g,才能使溶液恰好达到饱和。
26.(10分)白色粉末A由Na2S、Na2SO3、Na2S2O3、Na2SO4、NaCl等物质中的三种混合而成。取一定A样品投入100mL2.2mol/L盐酸中,充分反应后过滤,最终得到100mLH+浓度为1mol/L的溶液。若将此溶液蒸干,只得到8.19 g 纯净物B。
(1)B的化学式是___________。
(2)A中是否含有NaCl____________(填“有”“没有”)。
(3)若反应中还生成V L气体(标准状况下),且该气体不会使品红溶液褪色,则取出的A样品中含有Na2S___________mol(用含V的代数式表示)。
(4)A中各组成的物质的量比不同时,所产生的沉淀的量亦不同。上述A样品与盐酸反应可生成的沉淀物质的量最大值为__________________。
(提示:Na2S+2HCl=2NaCl+H2S↑,Na2SO3+2HCl=2NaCl+SO2↑+H2O,Na2S2O3+2HCl=2NaCl+SO2↑+S↓+H2O,2H2S+SO2=3S↓+H2O)
高三化学期中考试试卷答卷
姓名________班级________得分________
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三.(本题包括2小题,共18分)
19.(8分)
| 方案 | 操作过程 | 现象和结论 | |
| ① | |||
| ② | |||
| ③ | |||
| ④ | |||
20.(10分)(1)___________________________________________________
______________________(2)______________________________________。
(3)_____________________________________________________________
________________________________________________。(4)____________。
(5)_____________________________。
四.(本题包括2小题,共21分)
21.(10分)(1)A:______________B:______________C:______________
(2)___________________,_____________。
22.(11分)(1)_______,_______d,_______离子。(2)_____________
(3)________________(4)______________。
五.(本题包括2小题,共21分)
23.(9分)(1)________,___________________________________________。
(2)_______,理由是_____________________________________________
__________________________________________(3)___________________。
24.(12分)(1)甲______,乙______,丙______,丁______。
(2)___________,____________。(3)①______________________________,
②_______________________________。
六.(本题包括2小题,共18分)
25.(8分)
26.(10分)
高三化学期中考试试卷评分细则
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、C 2、D 3、D 4、C 5、D 6、A 7、B 8、C
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9、B 10、D 11、B 12、A 13、A 14、B 15、CD 16、D 17、AD 18、B
三.(本题包括2小题,共18分)
19、(8分)
| 方案 | 操作过程 | 现象和结论 |
| ① | 分别取少量固体溶解在试管中,加入过量BaCl2溶液 | 有白色沉淀的是Na2SO4,无白色沉淀的是NH4Cl |
| ② | 分别取少量固体溶解在试管中,加入适量NaOH溶液,加热,用湿润的酚酞试纸检验产生的气体 | 试纸变红的是Na2SO4,试纸不变红的是NH4Cl |
| ③ | 分别用铂丝蘸取两种固体放在酒精灯上灼烧 | 火焰呈黄色的是Na2SO4,火焰无色的是NH4Cl |
| ④ | 分别取少量固体放在试管中加热 | 分解且在试管口部有晶体析出的是NH4Cl,无明显现象的是Na2SO4 |
20、(10分)(1)根据阿伏加德罗定律,同温同压下两种相同体积的不同气体的质量之比等于它们的相对分子质量之比。(2分)
(2)为了保证瓶内的空气完全被排出,并充满了样品气(2分)
(3)第一次称量之前,锥形瓶塞紧后,在瓶口处的胶塞上做一个记号,以下每次测量,胶塞都塞到记号处(2分)(4)D(2分)
(5)[(m2-m1)ρ水+(m3-m2)ρ空气]×29.0/(m3-m1)ρ空气(2分)
四.(本题包括2小题,共21分)
21.(10分)(1)②(2分)⑥(2分)①③④⑤中的一种(2分)(2)⑤(2分)AB(2分)
22.(11分)(1)12(1分)![]() d(1分)钠(1分)(2)57.5%(3分)
d(1分)钠(1分)(2)57.5%(3分)
(3)96%(2分)(4)26%(3分)
五.(本题包括2小题,共21分)
23.(9分)(1)碱性(1分)A-+H2O![]() HA-+OH-(2分)(2)<(1分)第一步电离出的H+对HA-的电离起到抑制作用,使HA-更难电离出H+(2分)(3)Na+、HA-、H+、A2-、OH-(3分)
HA-+OH-(2分)(2)<(1分)第一步电离出的H+对HA-的电离起到抑制作用,使HA-更难电离出H+(2分)(3)Na+、HA-、H+、A2-、OH-(3分)
24.(12分)(1)HF(1分)H2O(1分)NH3(1分)NO(1分)(2)硫化氢(或臭氧等)(2分)![]() (2分)(3)①2F2+2H2O=4HF+O2(2分)②4NH3+5O2
(2分)(3)①2F2+2H2O=4HF+O2(2分)②4NH3+5O2![]() 4NO+H2O(2分)
4NO+H2O(2分)
六.(本题包括2小题,共18分)
25.(8分)(1)不是(3分)(2)42.9g(2分)(3)6.0g(3分)
26.(10分)(1)NaCl(2分)(2)有(2分)(3)V/77.2+0.04(3分)(4)0.08mol(3分)