高三化学期中试卷
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 K: 39 Al:27
S: 32 Fe: 56 Mg: 24 Cu: 64
一、 选择题(下列各题只有1个选项符合题意。每小题3分,共15分。)
1、亚硝酸盐外观类似于食盐,可能因误作食盐而发生食物中毒事故,欲鉴定之,可将亚硝酸盐或食盐用水溶解后,分别加入下列哪种溶液? ( )
A、NaNO3 B、AgNO3 C、KNO3 D、Cu(NO3) 2
2、在西北大开发中,将投巨资兴建“西气东送”工程,将西部蕴藏的半富资源通过管道输送到东部地区,这里所指的“西气”的主要成分是 ( )
A、CH4 B、CO C、H2 D、NH3
3、下列各组物质的相互关系不正确的是 ( )
A、同位素:H、D、T
B、同素异形体:C(石墨)、C60、C70
C、同系物:分子式为CnH2n的一切物质
D、同分异构体:[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O
4、生活中碰到某些问题,常常涉及到化学知识,下列分析不正确的是 ( )
A、当前我国环保急待解决的“白色污染”通常是指聚乙烯等塑料垃圾。
B、为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以单质形式存在。
C、工业酒精中含有甲醇,它虽也有酒香,但饮后会双目失明,甚至死亡。因此,严禁工业酒精兑水作饮用酒。
D、造成大气污染的SO2、CO和NOx主要来源于煤的燃烧、工厂和汽车排放的废气。
5、在水泥与冶金工厂,常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。该方法应用的原理是 ( )
A.渗析 B.电泳 C.丁达尔效应 D.过滤
二、 选择题(下列各题只有1—2个选项符合题意。每小题4分,共60分。)
6、下列叙述正确的是 ( )
A、只含有共价键的物质一定是共价化合物
B、含有离子键的化合物不一定是离子化合物
C、既有共价键又含有离子键的化合物既可算作共价物又可当成离子化合物
D、既有共价键又含有离子键的化合物一定是离子化合物
7、下列离子方程式正确的是 ( )
A、硫化氢通入硫酸铜溶液:Cu2++S2– ==CuS↓
B、碳酸钙和盐酸反应:CO32–+2H+==CO2↑+H2O
C、硫酸和氢氧化钡反应:Ba2+ +SO42– ==BaSO4
D、磷酸二氢钠加入过量的石灰水:2H2PO4– +3Ca2+ +4OH– ==Ca3(PO4)2↓+4H2O
8、某无色透明的酸性溶液中能大量共存的一组离子是 ( )
A.NH4+ 、NO3-、Fe2+、Cl- B.Na+、HS-、K+、SO42-
C.MnO4-、K+、SO42-、Na+ D.Mg2+、Al3+、SO42-、NO3-
9、实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角为180°,由此可见判断BeCl2属于 ( )
A、由极性键形成的极性分子
B、由极性键形成的非极性分子
C、各原子最外层都达到8电子稳定性结构分子
D、由非极性键形成的非极性分子
10、氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力都相同的是( )
A、硝酸钠和金刚石 B、晶体硅和水晶 C、冰和干冰 D、苯和萘
11、ClSO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是 ( )
A、此反应属于氧化还原反应 B、此反应不属于氧化还原反应
C、反应后溶液的pH值变小 D、反应后溶液的pH值增大
12、某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成,向溶液中加入烧碱溶液出现白色沉淀,加入稀硫酸也出现白色沉淀并放出气体。据此分析 ,下述组合判断中正确的是
( )
(1)肯定有BaCl2 (2)肯定有MgCl2 (3)肯定有NaHCO3
(4)肯定有Na2CO3或NaHCO3 (5)肯定没有MgCl2
A.⑴⑵⑶ B.⑴⑶ C.⑵⑷ D.⑴⑶⑸
13、已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6KJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l); ΔH=-2220KJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847KJ,则混合气体的物质的量之比为 ( )
A、 3:1 B、 1:4 C、1:3 D、1;1
14、用惰性电极电解M(NO3)x的水溶液,当阴汲上增重ag时,在阳极上同时产生bL氧气(标准状况):从而可知M的原子量为 ( )
A.22.4ax/b B11.2ax/b C.5.6ax/b D.2.5ax/b
15.取pH=4的某电解质溶液1.0L,用Pt电极进行电解,经过一段时间后,测得溶液pH=1,且阴、阳两极产物的物质的量之比为2:1,则该电解质溶液是 ( )
A、盐酸 B、氢氧化钾溶液 C、硝酸银溶液 D、硫酸铜溶液
16、有人设计将两根Pt丝做电极插入KOH溶液中,然后向两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为CH4 + 2O2 + 2KOH = K2CO3 + 3H2O; 则关于此燃料电池的下列说法中错误的是(一个电子所带电量为1.6ⅹ10-19C) ( ):
A、通过甲烷的电极为电池的负极,通过氧气的电极为正极
B、在标准状况下,每消耗5.6LO2,可向外提供9.6ⅹ104C的电量
C、通过甲烷的电极的电极反应为:CH4 + 10OH- -8e == CO32- + 7H2O
D、放电一段时间后,溶液的pH值升高
17、一定温度下,一定量的水中,石灰乳悬浊液存在如下平衡:
Ca(OH)2(s)![]() Ca2++2OH-, 当向其中加入少量生石灰时,下列说法正确的是( )
Ca2++2OH-, 当向其中加入少量生石灰时,下列说法正确的是( )
A、溶液中Ca2+数目减少
B、Ca2+浓度增大
C、溶液pH变小
D、以上都不对
18、第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,下列有关“类钫”的预测的说法中错误的是 ( )
A.单质有较高熔点 B.“类钫”在化合物中呈+1价
C.“类钫”具有放射性 D.“类钫”单质的密度小于1g/cm3
19、A,B,C分别代表3种不同的短周期元素,A元素原子的最外层只有2个电子,B元素原子的M电子层上的电子数比电子层数的2倍多1个,C元素原子核内有8个质子, 则这3种元素组成的化合物的化学式不可能是 ( )
A、ABC3 B、A(BC4)2 C、A(BC3)2 D、A(BC2)2
20、已知同周期X、Y、Z三种元素的最高价氧化物的酸性由强到弱的顺序是HXO4>H2YO4>H3ZO4,则 ( )
A.元素的非金属性按X、Y、Z的顺序增强
B.单质的氧化性按X、Y、Z的顺序减弱
C.阴离子的还原性按X、Y、Z的顺序减弱
D.气态氢化物的稳定性按X、Y、Z的顺序减弱
三、填空题(共23分)
21、(10分)(1)卫星发射时可用肼(N2H4)为燃料,1 gN2H4(气态)在O2(气态)中燃烧,生成N2(气态)和H2O(气态),放出16.7kJ的热量,写出有关的热化学方程式
。
(2)氢氧化钡溶液中通入足量的CO2气体,写出其离子方程式 。(3)18g普通水(H2O)和40g重水(D2O)分别与足量的金属钠反应,在同温同压下产生气体的体积比______,质量比______,消耗金属钠的质量比_______。
22、(7分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,已知它的氧化性强于KMnO4,在反应中本身被还原为Fe3+,将它溶入浑浊的泥水中,既能起杀菌消毒作用,又能使泥浊沉降,试回答:
(1)配平制取铁酸钠的反应方程式:
_ _Fe(NO3)3+_ __NaOH+_ _Cl2—_ _Na2FeO4+_ _NaNO3+_ _NaCl+_ _H2O
该反应中的还原产物是___ _。
(2)铁酸钠能沉降泥浊的原因是_______________ __ ___。
 23、(6分)、按要求回答下列问题
23、(6分)、按要求回答下列问题
(1)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有 个C原子。
(2)NaCl晶体中每个Na+周围有 个Cl-,每个Na+周围与它最近且距离相等的Na+共有 个。
(3) 观察干冰晶体结构,试分析:与二氧化碳分子距离最近且相等的二氧化碳分子有______个。
(4)NH3分子的空间结构为 ,当结合H+后,形成的NH4+离子的空间结构为 。
四、推断题(共10分)
24、(10分).A+、B+、C-、D、E五种微粒(分子或离子),每个微粒均含有10个电子.已知 ①A++C-![]() D+E↑ ②B++C-
D+E↑ ②B++C-![]() 2D
2D
请回答以下问题:
(1)C-的电子式为____________
(2)具有相同空间构型的微粒是______和________
(3)分别写出A+和D反应,B+和E反应的离子方程式。
A++D:_______________________
B++E:________________________
五、实验题(共22分)
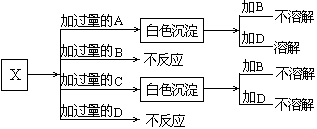 25、(10分)、A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定.试确定A、B、C、D、X各代表何种溶液.
25、(10分)、A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种.现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定.试确定A、B、C、D、X各代表何种溶液.
A: B: C: D: X:
26、(12分)、已知浓硫酸与木炭粉在加热条件下反应生成SO2、CO2和H2O。试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
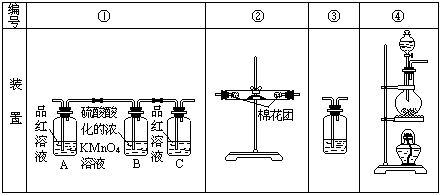 |
(1)这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):
→ → → 。(3分)
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 ;B瓶溶液的作用是 ;C瓶溶液的作用是 。(3分)
(3)装置②中所加的固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 。(4分)
(4)装置③中所盛溶液是 ,可验证的产物是 。(2分)
六、计算题(20分)
27、(8分)将10.08g铁粉溶于过量的稀硫酸,所得溶液加入5.05gKNO3氧化溶液中的Fe2+,待反应完毕后,剩余的Fe2+尚需30ml 0.5mol/L的溴水才能全部氧化,试写出三步反应的化学方程式。
28、(12分) 以石墨为电极,电解1LCuSO4和NaCl的混合溶液,其中CuSO4与NaCl的物质的量之和为0.2mol,CuSO4的物质的量占总物质的量的比值为x。
(1)x=0.5,当Cu2+在阴极恰好全部析出时,产生的气体是什么?物质的量为多少?所得溶液的pH值为多少?(忽略溶液体积的变化)
(2)电解一段时间后,阴、阳极产生气体的物质的量恰好相等,均为0.16mol,试求x值。
参考答案
一、选择题
1、B 2、A 3、C 4、B 5、B
二、选择题
6、D 7、D 8、D 9、B 10、B
11、BC 12、B 13、C 14、C 15、D
16、D 17、AC 18、AD 19、A 20、AD
三、 填空题
21、(1)N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=—534.4KJ/mol
(2)OH—+CO2= HCO3—
(3)1﹕2 , 1﹕4 , 1﹕2
22、(1)2,16,3—2,6,6,8 NaCl
(2)Na2FeO4杀菌消毒后,被还原成Fe3+,Fe3+水解成Fe(OH)3胶体,使泥浊沉降。
23、(1)6 (2)6,12 (3)12 (4)三角锥形,正四面体
四、推断题
![]() 24、
(1) [ O H
]- (2)NH3,H3O+ (3) NH4++H2O =NH3·H2O+H+.
24、
(1) [ O H
]- (2)NH3,H3O+ (3) NH4++H2O =NH3·H2O+H+.
NH3+H3O+ =NH4++H2O
五、实验题
25、A、NaOH B、NaNO3 C、Ba(NO3)2 D、 HNO3 X、MgSO4
26、(1)4→2→1→3 (2)验证SO2气体的存在,除去SO2气体,验证SO2气体是否已除尽
(3)CuSO4,H2O,①③装置都为水溶液,气体通过会带出水分。
(4)Ca(OH)2溶液,CO2
六、计算题
27、Fe+H2SO4 ==FeSO4+H2↑
6FeSO4+4H2SO4+2KNO3=3Fe2(SO4)3+K2SO4+2NO+4H2O
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr2
28 、(1)Cl2,O2;0.05mol, 0.025mol, PH=1
(2)X=0.6