绝密 ★ 启用前 (四月号)
高三化学全国统一标准测试2
化 学 (B卷)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试用时90分钟。
可能用到的相对原子质量:H 1 C 12 I 127 O 16 K 39
第Ⅰ卷 (选择题 共16题 共40分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
3.如果不采用答题卡答题,请把第Ⅰ卷(选择题)的答案填入第Ⅱ卷的选择题答题栏中。
一、选择题:每小题2分,共16分。在下列各题的四个选项中,只有一个选项是最符合题目要求的。
1.2003年2月1日,美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨
A.具有导电性,防辐射
B.密度小,减轻机身重量
C.熔点高,化学性质稳定
D.硬度小,有润滑作用
2.生活中碰到的某些问题常常涉及到化学知识,下列叙述不正确的是
A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
B.家用消毒液发生器其原理是用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液
C.血液是由血球在血浆中形成的胶体,因而肾功能衰竭的病人血液中的毒素可以通过透析的方法除去
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打溶液或稀氨水
3.以下关于碳族元素的性质叙述错误的是
A.碳单质(金刚石)和硅单质(晶体硅)的结构相似
B.碳的氧化物(CO2)和硅的氧化物(SiO2)的结构相似
C.碳的含氧酸(H2CO3)和硅的含氧酸(H2SiO3)结构相似
D.碳的氢化物(甲烷)和硅的氢化物(硅烷)结构相似
4.2002年9月14日,南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂——毒鼠强,导致多人中毒死亡;已知毒鼠强的结构简式如右图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是
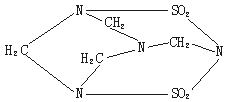
A.毒鼠强属于无机物
B.毒鼠强属于烃
C.毒鼠强分子内含SO2分子,因而具有毒性
D.毒鼠强的分子式为C4H8N4S2O4
5.饮用水的消毒剂有多种,其中杀菌能力强,又不影响水质的理想消毒剂是
A.漂白粉 B.苯酚
C.氯气 D.臭氧
6.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
7.A、B、C、D四地的地理位置如下图所示,交通均较为便利,其他地理条件如下。根据以下信息,在硫酸厂厂址的选择时应选择
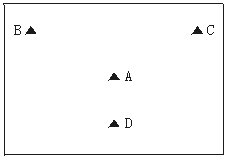
A地是风景旅游城市;B地是硫酸消费中心;C地有较为丰富黄铁矿资源;D地有少量的硫酸消费
A.A地 B.B地
C.C地 D.D地
8.加氟牙膏是含有微量氟化物的添加剂,可防止龋齿,长期使用加氟牙膏在牙齿表面生成了一层质地坚硬、溶解度小的氟磷酸钙。其化学式为CaxFy(PO4)z,已知x、y、z都是奇数,其中x等于5。1 mol CaxFy(PO4)z中含有氟离子的物质的量为
A.4 mol B.3 mol
C.5 mol D.1 mol
二、选择题:每小题3分,共24分。在下列各题的四个选项中,只有一个选项是最符合题目要求的。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4\5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置 ②滤出固体物质 ③将滤出的固体物质加热煅烧 ④把煅烧后的物质放在硫酸中溶解 ⑤调节溶液的pH到3.4~4,使Fe(OH)3沉淀完全,过滤 ⑥浓缩滤液,析出晶体 ⑦将过滤得到的晶体溶解,再结晶
据以上叙述回答9~11题。
9.上述③步操作所得煅烧产物成分是
A.CuO B.CuO和FeO
C.Fe2O3 D.CuO和Fe2O3
10.上述第⑤步操作中,调节溶液的pH宜加入的物质是
A.氧化铜粉末 B.NaOH溶液
C.稀氨水 D.Na2CO3
11.上述⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高,CuSO4溶解度增大
C.温度升高,Cu2+水解完全,得到Cu(OH)2
D.温度升高,CuSO4分解
12.燃烧1 g乙炔(C2H2)生成二氧化碳和液态水,放出热量50 kJ,则这一反应的热化学反应方程式为
A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH=+50 kJ/mol
B.C2H2(g)+5/2O2(g)====2CO2(g)+H2O(l);ΔH=-1300 kJ
C.2C2H2+5O2====4CO2+2H2O;ΔH=-2600 kJ
D.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH=-2600 kJ/mol
13.下列反应的离子方程式不正确的是
A.Ca(ClO)2溶液中通过量的CO2:Ca2++2ClO-+H2O+CO2====CaCO3↓+2HClO
B.FeSO4溶液中加H2O2:4Fe2++2H2O2+4H+====4Fe3++4H2O
C.用氨水吸收过量的SO2:NH3·H2O+SO2====NH+4+HSO-3
D.Fe(NO3)3溶液中加过量氨水:Fe3++3NH3·H2O====Fe(OH)3↓+3NH![]()
14.在相同条件下(T=500 K),相同体积的甲、乙两容器中,甲充入1 g SO2、1 g O2,乙充入2 g SO2、2 g O2,下列叙述中错误的是
A.化学反应速率:乙>甲
B.SO2转化率:乙>甲
C.平衡后O2浓度:乙>甲
D.平衡后SO2的体积分数:乙>甲
15.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是
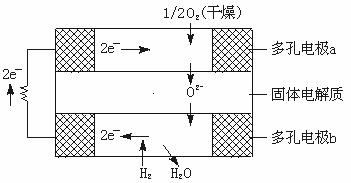
A.有O2进入发生反应的a极为电池的负极
B.有H2进入发生反应的b极为电池的正极
C.a极对应的电极反应为:O2+2H2O+4e-====4OH-
D.该电池的总反应方程式为:2H2+O2![]() 2H2O
2H2O
16.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO![]() )。其平衡关系如下:
)。其平衡关系如下:
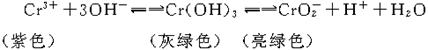
向0.05 mol·L-1的Cr2(SO4)3溶液50 mL中,加入1.0 mol·L-1的NaOH溶液50 mL,充分反应后,溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
绝密 ★ 启用前 (四月号)
全国统一标准测试
化 学 (B卷)
第Ⅱ卷(非选择题 共9题 共60分)
注意事项:
1.用钢笔或圆珠笔直接答在试题卷中。
2.答卷前将密封线内的项目填写清楚。
三、本题包括3小题,共20分。
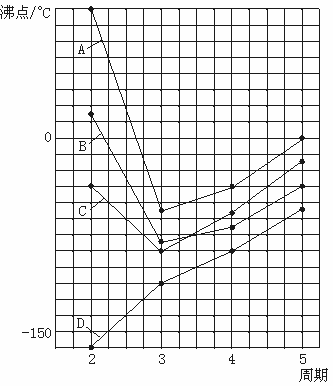
17.(8分)下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线__________;表示ⅣA族元素气态氢化物沸点的是曲线__________;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是__________________________;A、B、C曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是________________________。
18.(5分)已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为__________(填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为__________。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)__________c(CH3COOH)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+)__________c(OH-)。
19.(7分)据下列信息完成所需回答的问题:
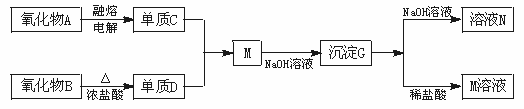
其中氧化物A是白色固体;氧化物B是黑色固体;单质C不溶于冷的浓硝酸。
(1)D是__________;G是__________。(填化学式)
(2)元素C位于周期表中第__________周期__________族。
(3)写出下列反应的离子方程式
B+浓盐酸_____________________________。
G+NaOH溶液___________________________。
(4)单质C不与冷的浓硝酸反应的原因是__________________________。
四、本题包括2小题,共16分。
20.(8分)铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如下图所示的实验装置。实验步骤如下:
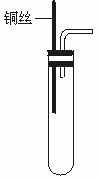
①检查装置的气密性;
②向试管中加入一定量碳酸钙固体;
③向试管中倒入过量的稀硝酸,并迅速盖上带铜丝和导管的橡皮塞;
④待反应完全后,将导管插入试管内接近液面;
⑤将铜丝插入到溶液中;
⑥用注射器向试管内推入氧气(或空气)。
请回答下列问题:
(1)实验中加入CaCO3的作用是__________________________。
(2)实验中推入氧气或空气的目的是__________________________。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异的结果,你同意这种看法吗?__________(填“同意”或“不同意”),原因是__________________________;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之。(简述实验方案和实验现象)__________________________。
21.(8分)乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
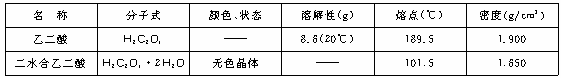 注:表中“——”是尚未有具体数据。
注:表中“——”是尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为__________;说明乙二酸的酸性比碳酸__________。
(2)向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到的现象为__________;说明乙二酸有__________性。
(3)已知草酸分解的化学方程式为H2C2O4![]() H2O+CO2↑+CO↑。为了验证草酸受热分解及其产物,用右图装置进行实验,加热草酸晶体,有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的四个不合理的主要原因。
H2O+CO2↑+CO↑。为了验证草酸受热分解及其产物,用右图装置进行实验,加热草酸晶体,有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出用该装置进行实验可能存在的四个不合理的主要原因。
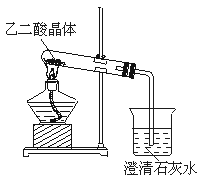
答:①_____________________________________________;
②_____________________________________________;
③_____________________________________________;
④_____________________________________________。
五、本题包括2小题,共12分。
22.(6分)2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
![]()
回答下列问题:
(1)聚乙炔的碳链结构片段可表示为__________。
![]() (2)下列叙述正确的是__________。
(2)下列叙述正确的是__________。
A.这种可导电的塑料是一种纯净物,有固定的熔、沸点
B.掺杂后的聚乙炔所以可导电,是因为它具有类似盐的结构
C.聚乙炔和碘的掺杂反应中,聚乙炔被还原
D.聚乙炔经掺杂反应后,分子内碳链结构未发生变化
(3)试写出用钠做掺杂实验的通式_________________。
23.(6分)中国是《日内瓦协定书》的缔约国,2003年12月3日,发表了《中国的防扩散政策和措施》白皮书,重申反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如右图所示:
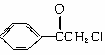
(1)苯氯乙酮不可能具有的化学性质是__________(填序号)。
A.加成反应 B.取代反应
C.消去反应 D.水解反应
E.银镜反应
(2)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含—CH3的化合物有多种,请举出两例,写出它们的结构简式。(这两例分子内必须含有不同的基团)
六、本题包括2小题,共12分。
24.(6分)在沥青蒸气里含有多种稠环芳香烃,其中一些可视为同系物,如A,B,C……所示。它们都含有偶数个苯环结构。
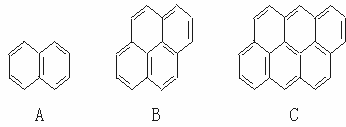
(1)该系列化合物中,相邻两化合物间递增的CnHm值中的n和m的数值分别是n=__________,m=__________。
(2)从萘开始,这一系列化合物中的第25个分子式是__________。
(3)该系列化合物中碳的最大质量分数是__________。
25.(6分)20.00 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如右图所示。
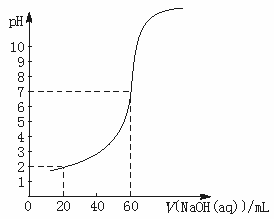
(1)试求X、Y的物质的量浓度之比。
(2)求盐酸的物质的量浓度。
参 考 答 案
一、1.C 2.A 3.B 4.D 5.D 6.C 7.B 8.D
二、9.D 10.A 11.A 12.D 13.A 14.D 15.D 16.C
三、17.(每空2分,共8分)A D 同族元素的氢化物相对分子质量越大,分子间作用力越大,沸点越高 H2O、HF、NH3分子间存在氢键,使分子间作用力显著增大,因而沸点显著升高
18.(每空1分,共5分)(1)醋酸钠 ① (2)醋酸和醋酸钠 (3)小于 小于
19.(7分)(1)Cl2 Al(OH)3(2分) (2)三 ⅢA(2分)
(3)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O(1分) Al(OH)3+OH-====AlO-2+2H2O(1分) (4)铝遇到冷的浓硝酸钝化(1分)
Mn2++Cl2↑+2H2O(1分) Al(OH)3+OH-====AlO-2+2H2O(1分) (4)铝遇到冷的浓硝酸钝化(1分)
四、20.(8分)(1)和硝酸反应产生的CO2气体可将试管内的空气排出(2分)落不明 (2)检验生成的NO气体(2分) (3)不同意(1分) 铜片质量相同,溶液体积相同,生成的Cu2+离子浓度相同(1分) 加热绿色溶液,有红棕色气体产生,溶液变成蓝色(2分)(其他合理的方法如向溶液中通入CO2↑将溶液的NO2气体驱走,溶液变蓝色等均可参照给分)
21.(8分)(1)有无色气体放出(1分) 强(1分) (2)溶液仍呈无色或溶液紫红色褪去(1分) 还原(1分) (3)(每答出一个正确的原因给1分,答到4个就给满分)①草酸晶体的熔点低,未分解之前就已熔化并流到试管口处,不能完成分解实验 ②该装置只能检验一种分解产物(CO2),不能检验是否有其他分解产物 ③在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成了草酸钙沉淀,对实验有干扰 ④生成的CO未能除去,会污染空气。⑤乙二酸晶体含有结晶水,因而加热后无法证明草酸的分解产物中含水
五、22.(6分)(1)B
(2)D (3)[CH]n+xNa-→[CH]![]() +xNa+(每空2分)
+xNa+(每空2分)
23.(6分)(1)CE(2分) (2)结构简式如下,写出邻、间、对位异构体均可,但必须有不同基团的两种,每写对一个给2分,只要写出其中两个就给满分。
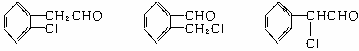
六、24.(6分)(1)6 2 (2)C154H56
(3)含碳(C%)=![]() ×100%=
×100%=![]() ×100%
×100%
当n→∞时,含碳最大质量分数=![]() ×100%=97.3%
×100%=97.3%
25.(6分)(1)0.200 L×c(HCl)=0.600 L×c(NaOH)
![]() =
=![]() (3分)
(3分)
(2)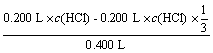 =10-2(mol/L)
=10-2(mol/L)
c(HCl)=0.0300 mol/L(3分)