北 京 四 中
年 级:高 三 科 目:化 学 编稿老师:潘廷宏
审稿老师:潘廷宏 责 编:广 毅 录 入:刘艳娥
高三化学实验(三)
七、重要的定量实验:
1.配制一定物质的量浓度的溶液
①实验操作步骤(见前面实验基本操作)
②误差分析:
配制溶液的烧杯未用蒸馏水洗涤2~3次后,将洗涤液移入容量瓶(偏低)
定容后摇匀,发现液面低于刻度线,重新用滴管加水至刻度线(偏低)
定容时,若仰视刻度,溶液浓度偏低,俯视刻度,溶液浓度偏高
2.硫酸铜晶体中结晶水含量的测定
①实验操作步骤:称量坩埚质量(W1),装入适量硫酸晶体铜,再称量坩埚和硫酸铜晶体的总质量(W2)。充分加热直到晶体变为白色粉末。在干燥器内冷却至室温,再称量无水硫酸铜及坩埚的总质量(W3)。重复操作,直到称量的W3的误差小于0.1克
结晶水的含量= ![]() ×100%
×100%
②误差分析:
测定值偏高的原因有:原晶体不干燥,带有少量水;加热时温度过高,有CuO出现;晶体中含受热易分解的杂质;加热时少量晶体溅出坩埚。
测定值偏低的原因有:加热不充分,硫酸铜晶体中还存在结晶水;加热后的白色粉末在空气中放置冷却;晶体中含受热不分解、有挥发的杂质。
3.中和滴定(选用)
①实验操作步骤(见基本操作)
②指示剂的选择原则
a.颜色变化由浅到深;b.指示剂变色范围和滴定混和液pH值相匹配;
③误差分析:
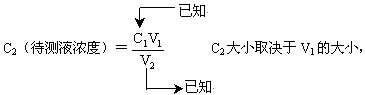
各种因素造成的误差最终通过V1表现出来,所以只要分析V1的大小来判断C2的大小。
ⅰ来自滴定管上产生的误差
盛标准液的滴定管用蒸馏水洗涤后未用标准液润洗(偏高)
盛待测液的滴定管用蒸馏水洗涤后未用待测液润洗(偏低)
盛标准液的滴定管滴定前有气泡,滴后无气泡(偏高)
盛待测液的滴定管滴定前有气泡,滴后无气泡(偏低)
锥形瓶用蒸馏水洗涤后又用待测液润洗(偏高)
ⅱ来自配制标准液产生的误差
配制0.1mol/L NaOH溶液500mL做为标准液。需要NaOH质量2g
NaOH已部分潮解(偏高)
NaOH中含有杂质,杂质不与待测液反应(偏高)
NaOH中所含杂质消耗1mol盐酸需质量大于40g(如含Na2CO3、NaHCO3)(偏高)
NaOH中所含杂质消耗1mol盐酸需质量小于40g(如含Na2O)(偏低)
ⅲ来自读数产生的误差
量取待测液时先俯视后仰视(偏低)先仰视后俯视(偏高)
测量标准液时先俯视后仰视(偏高)先仰视后俯视(偏低)
八、实验方案的设计与评价
实验能力的高低,主要表现在实验方案的设计与评价。
实验方案的设计要注意以下几点:
1.首先要明确实验目的和原理,因为它们决定了实验仪器和试剂的选择,操作步骤,明确了目的和原理就可以居高临下,统观全局。
2.要注意排除实验中的干扰因素。
不论是制备实验、性质实验还是定量实验都会有干扰因素,因此要设计合理的方案排除干拢,以保证达到实验目的。
3.审题时,要注意选择、利用题目中提供的信息。
4.设计方案要前后联系,彼此呼应,防止出现片面性,造成失误。
实验方案的评价要注意。
评价实验方案一般从以下几个方面进行分析:
1.是否符合实验原理,能否达到实验目的;
2.操作是否简单易行;
3.试剂,原料的价格成本;
4.是否利于环境保护;
5.是否安全可靠等。
对不同的方案对比异同和优劣。从而设计出合理的实验方案。
【例题分析】
例1.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃,拟利用图中的仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
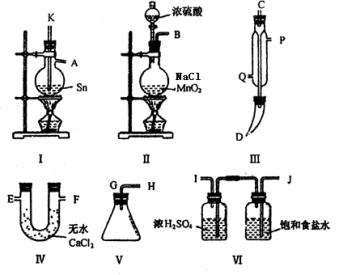
(1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________接________、________接________、________接________。
(2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。
(3)冷凝管理冷却水的流向是从__________进入,从__________流出。
(4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。
(5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________。
(6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。
(7)为了防止污染空气,在装置的最后应____________。
分析:这是一个制备实验。
实验目的是:制备无水SnCl4
实验原理是:Sn+2Cl2 ![]() SnCl4
SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2 ![]() Na2SO4+MnSO4+Cl2↑+2H2O
Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
答案:
(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4 ![]() 2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃ Sn粒熔化
(5)SnCl4+2H2O=SnO2+4HCl (6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
例2.为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),某学生设计了实验装置如图
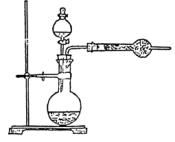 (1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数= ![]() ×100%
×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
分析:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2Cl3反应生成Cl2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x W2-W1
x= ![]() g
g
= ![]() g
g
Na2CO3%= ![]() ×100%
×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。
补救的办法:如图
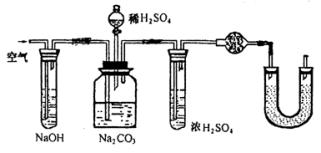
①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
例3.实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
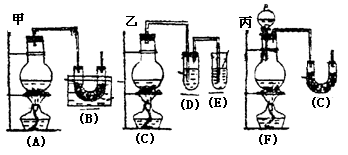
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分)
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
| 1 | 优点 | 缺点 |
| 甲装置 | 1 | 1 |
| 乙装置 | 1 | 1 |
| 丙装置 | 1 | 1 |
(2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流左到右方向)为_____________,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因_____________________。
分析:这是一道评价实验方案的题。该题从是否有副反应发生,是否易控制反应速率,是否防止污染,是否干扰反应产物等方面进行评价。
答案:
(1)优点 缺点
甲装置d a、e
乙装置f a、c
丙装置b e、c
(2)F~B~E
在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。