北 京 四 中
年 级:高 三 科 目:化 学 编稿老师:潘廷宏
审稿老师:潘廷宏 责 编: 广 毅 录 入:刘艳娥
高三化学实验复习(一)
化学实验包括的内容有
一.常用化学仪器及使用方法;
二.化学实验基本操作;
三.常见气体的制备;
四.物质的分离、提纯;
五.物质的检验;
六.常见试剂的保存;
七.综合实验—实验方案的设计和评价。
在实验中复习对于基本实验要熟练掌握原理和基本操作,在此基础上,顺利地完成实验方案的设计。
一、常用化学仪器及使用方法
(一)能直接加热的仪器
| 仪器图形与名称 | 主要用途 | 使用方法和注意事项 |
| | 用于蒸发溶剂或浓缩溶液 | 可直接加热,但不能骤冷。蒸发溶液时不可加得太满,液面应距边缘1厘米处。 |
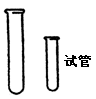
| | 常用作反应器,也可收集少量气体 | 可直接加热,拿取试管时,用中指、食指、拇指拿住试管口占全长的1/3处,加热时管口不能对着人。放在试管内的液体不超过容积的1/2,加热的不超过1/3。加热时要用试管夹,并使试管跟桌面成45°的角度,先给液体全部加热,然后在液体底部加热,并不断摇动。给固体加热时,试管要横放,管口略向下倾。 |
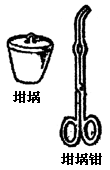
| | 用于灼烧固体,使其反应(如分解) | 可直接加热至高温。灼烧时应放于泥三角上,应用坩埚钳夹取。应避免聚冷。 |
| | 燃烧少量固体物质 | 可直接用于加热,遇能与Cu、Fe反应的物质时要在匙内铺细砂或垫石棉绒。 |
2.能间接加热(需垫石棉网)
| 仪器图形和名称 | 主要用途 | 使用方法和注意事项 |
| | 用作配制、浓缩、稀释溶液。也可用作反应器和给试管水浴加热等。 | 加热时应垫石棉网 |
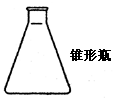
| | 用作反应器(特别是不需加热的) | 不能直接加热,加热时要垫石棉网。不适于长时间加热,当瓶内液体过少时,加热容易使之破裂。 |
| | 用作在加热条件下进行的反应器 | 不能直接加热,应垫石棉网加热。所装液体的量不应超过其容积1/2。 |
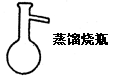
| | 用于蒸馏与分馏,也可用作气体发生器 | 加热时要垫石棉网。也可用其他热浴。 |
| | 用作接受器 | 一般放在石棉网上加热。在滴定操作中液体不易溅出。 |
3.不能加热的仪器
| 仪器图形与名称 | 主要用途 | 使用方法及注意事项 |
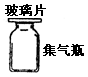
| | 用于收集和贮存少量气体 | 上口为平面磨砂,内侧不磨砂,玻璃片要涂凡士林油,以免漏气,如果在其中进行燃烧反应且有固体生成时,应在底部加少量水或细砂。 |
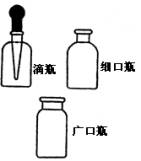
| | 分装各种试剂,需要避光保存时用棕色瓶。广口瓶盛放固体,细口瓶盛放液体。 | 瓶口内侧磨砂,且与瓶塞一一对应,切不可盖错。玻璃塞不可盛放强碱,滴瓶内不可久置强氧化剂等。 |
| | 制取某些气体的反应器固体+液体 | 固体为块状,气体溶解性小反应无强热放出,旋转导气管活塞控制反应进行或停止。 |
(二)计量仪器
| 仪器图形与名称 | 主要用途 | 使用方法及注意事项 |
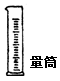
| | 用于粗略量取液体的体积 | 要根据所要量取的体积数,选择大小合适的规格,以减少误差。不能用作反应器,不能用作直接在其内配制溶液。 |
| | 用于准确配制一定物质的量浓度的溶液 | 不作反应器,不可加热,瓶塞不可互换,不宜存放溶液,要在所标记的温度下使用 |
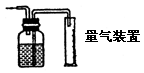
| | 用于量取产生气体的体积 | 注意:所量气体为不溶性的,进气管不能接反,应短进长出。 |
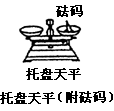
| | 用于精确度要求不高的称量 | 药品不可直接放在托盘内,左物右码。若左码右物,则称取质量小于物质的实际质量。例如,称取9.6g实际质量为9-0.6=8.4g。一般精确到0.1g。 |
| | 用于中和滴定(也可用于其他滴定)实验,也可准确量取液体体积 | 酸式滴定管不可以盛装碱性溶液,强氧化剂(KMnO4溶液、I2水等)应放于酸式滴定管,“零”刻度在上方,精确到0.01ml。 |
| 胶头滴管 | 用于吸取或滴加液体,定滴数地加入滴夜。 | 必须专用,不可一支多用,滴加时不要与其他容器接触。 |
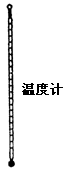
| | 用于测量温度 | 加热时不可超过其最大量程,不可当搅拌器使用,注意测量温度时,水银球的位置。 |
(三)用作过滤、分离、注入容液仪器
| 仪器图形与名称 | 主要用途 | 使用方法及注意事项 |
| | 用作过滤或向小口容器中注入液体 | 过滤时应“一贴二低三靠” |
| | 用于装配反应器,便于注入反应液 | 应将长管末端插入液面下,防止气体逸出 |
| | 分离密度不同且互不相溶的液体;作反应器的随时加液装置 | 分液时,下层液体从下口放出,上层液体从上口倒出;不宜盛碱性液体 |
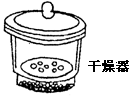
(四)干燥仪器
| 仪器图形与名称 | 主要用途 | 使用方法及注意事项 |
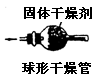
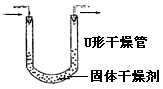
| | 内装固体干燥剂或吸收剂,用于干燥或吸收某些气体 | 要注意防止干燥剂液化和是否失效。气流方向大口进小口出。 |
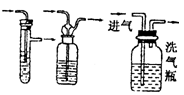
| | 除去气体中的杂质 | 注意气流方向应该长管进气,短管出气 |
| | 用于存放干燥的物质或使滴湿的物质干燥 | 很热的物质应稍冷后放入 |
(五)其它仪器
| 仪器图形与名称 | 主要用途 | 使用方法及注意事项 |
| | 用于蒸馏分馏,冷凝易液化的气体 | 组装时管头高,和尾低,蒸气与冷却水逆向流动 |
| | 用作热源,火焰温度为500℃~600℃ | 所装酒精量不能超过其容积的2/3,但也不能少于1/4。加热时要用外焰。熄灭时要用盖盖灭,不能吹灭 |
| | 用作热源,火焰温度可达1000℃左右 | 需要强热的实验用此加热。如煤的干馏,炭还原氧化铜 |
| | 可用作蒸发皿或烧杯的盖子,可观察到里面的情况 | 不能加热 |
(六)夹持仪器
铁架台、铁夹、试管夹、滴定管夹、坩埚钳、三角架、泥三角、镊子、石棉网等。
(七)连接的仪器及用品
单孔器、双孔塞、无孔塞、玻璃导管、橡皮管。
另外还有一些仪器,玻璃棒、试管刷、研钵、接收器
二、化学实验基本操作
1.试剂的取用
固体粉末状药品取用时用药匙或纸槽送入横放的试管中,然后将试管直立,使药品全部落到底部。药量一般以盖满试管底部为宜。
块状固体则用镊子夹取放入横放的试管中,然后将试管慢慢直立,使固体沿管壁缓慢滑下。
液体药品根据取用药品量的不同采用不同的方法。取用少量时,可用胶头滴管吸收。取一定体积的液体可用滴定管或移液管。取液体量较多时可直接倾倒。往小口径容器内倾倒液体时(如容量瓶)应用玻璃棒引流。
2.玻璃仪器的洗涤
(1)水洗法:在试管中注入少量水,用合适毛刷蘸洗涤剂刷洗,再用水冲洗,最后用蒸馏水清洗,洗涤干净的标志是:附着在玻璃仪器内壁上的水既不聚成水滴,也不成股流下。
(2)药剂洗涤法:
①附有不溶于水的碱、碱性氧化物、碳酸盐。可选用稀盐酸清洗,必要时可稍加热
②附有油脂,可选用热碱液(Na2CO3)清洗
③附有硫磺,可选用CS2或NaOH溶液洗涤
④附有碘、苯酚、酚醛树脂的试管用酒精洗涤
⑤作“银镜”、“铜镜”实验后的试管,用稀硝酸洗
⑥用高锰酸钾制氧气后的试管附有二氧化锰,可用浓盐酸并稍加热后再洗涤
⑦盛乙酸乙酯的试管用乙醇或NaOH溶液洗涤。
3.常见指示剂(或试纸)的使用
①常见的酸碱指示剂有石蕊、酚酞和甲基橙,应熟记它们的变色范围。使用时将指示剂取几滴滴加到试管中的待测液中,观察颜色变化。
②常见试纸有石蕊试纸(红色或蓝色)、PH试纸(黄色)、淀粉碘化钾试纸(白色)以及酸铜铅试纸等;用试纸测气体的酸碱性时,应用镊子夹着试纸,润湿后放在容器的气体出口处,观察颜色的变化。使用pH试纸时应把试纸放在玻璃片或表面皿上,用玻璃蘸取待测涂涂在试纸上,及时用比色卡比色,读出待测液的pH值,注意pH试纸不能用水润湿。要注意切不可把试纸投入到溶液中。
Cl2、Br2、NO2、O2等氧化性较强的气体,均可使润湿的淀粉碘化钾试纸变蓝。
4.溶液的配制
①配制一定质量分数溶液的操作步骤:
计算、称量(对固体溶质)或量取(对液体物质)、溶解。
②配制一定物质的量浓度溶液的操作步骤:
计算(溶质质量或体积)、称量或量取、溶解、降至室温、转入容量瓶中、洗涤(2~3次,用玻璃棒再次移入)、定容(加水到刻度线下2~3厘米处,改用胶头滴管加至凹液面最低点与刻度相切)、摇匀、装瓶(注明名称、浓度)
说明:在溶解时放出大量的热的物质,例如浓硫酸的稀释、浓硫酸和浓硝酸混合,都应把密度较大的浓硫酸沿器壁慢慢注入另一种液体中,并用玻璃棒不断搅拌。
5.物质的分离与提纯中的基本操作
| 操作名称 | 适用范围和实例 | 装 置 | 操作要点 |
| 过滤(沉淀洗涤) | 固体(不溶)一液体分离 | | (1)对折法折叠滤纸后紧贴漏斗壁,用水打湿不出气泡为止,滤纸边缘低于漏斗;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”。 |
| 蒸发结晶(重结晶) | 固体一液体分离,例:食盐溶液的蒸发结晶。 | | (1)蒸发皿可直接受热。固定在铁架台的铁环上。 |
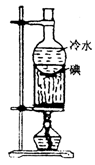
| 蒸馏分馏 | 分离沸点不同的液体混和物 | | (1)蒸馏烧瓶加热要垫石棉网,温度计水银球放在支管口各向下的位置。 |
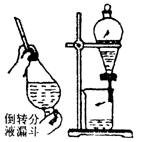
| 萃取分液 | 将两种互溶的液体分开。将两种互不相溶的液体分开。 |
| (1)将溶液注入分液漏斗,溶液总量不超过其容积3/4,如图所示,两手握住分液漏斗、倒转分液漏斗并反复、用力振荡。 |
| 洗气 | 气一气分离(杂质气体与试剂反应)例:用饱和食盐水除去Cl2气中的HCl杂质,用Br2水除去CH4中的C2H2。 | | 混和气体通入洗气瓶 |
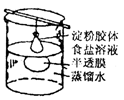
| 渗析 | 胶粒与溶液中的溶质分离。例:用渗析的方法除去淀粉胶体中的NaCl。 | | 将要提纯的胶体装入半透膜中,将半透膜袋系好,浸入蒸馏水中,渗析的时间要充分。 |
| 加热 | 杂质发生反应。例:Na2CO3中含有NaHCO3杂质。MnO2中混有炭粉杂质可用加热法除去。 | | 用玻璃棒搅拌,使受热均匀 |
| 升华 | 分离易升华的物质。例:碘、萘的提纯 | | 1 |
| 盐析 | 胶体从混和物中分离出来。例:硬脂酸钠溶液中加入食盐细粒;鸡蛋白溶液中加入饱和(NH4)2SO4溶液 | 1 | 1 |
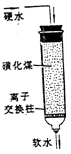
| 离子交换 | 将溶液中的离子与液体分离。例:软化硬化 | | 1 |
6.中和滴定
①准备过程:检查滴定管是否漏水;用水洗涤玻璃仪器;用少量标准液或待测液润洗装标准液的滴定管或装待测液的滴定管;装液体(在锥形瓶中放一定量待测液),排气泡、调零点并记录初始读数。当然也可以用待测液滴定标准液。
②滴定过程:
姿态:左手控制活塞或小球,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。
滴速:逐滴滴入,当接近终点时,应一滴一摇。
终点:最后一滴刚好使指示剂颜色发生明显改变时即为滴定终点。记录读数(半分钟不褪色)
③数据处理及误差分析(略)
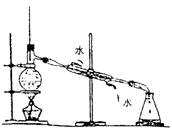
7.气体发生器的气密性检查(见图7-1、图7-2所示)
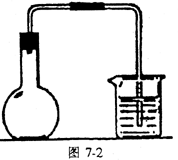
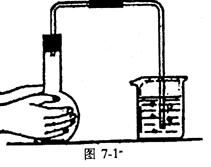
用试管、烧瓶作气体发生器时,应将导气管的末端浸入水中,用双手捂住反应器的外壁或微热反应器。若有气泡产生,移开手掌或热源,过一会儿,有水进入导管形成一段水柱,则证明气密性良好。
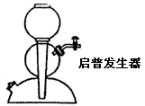
用启普发生器作气体发生器时,应将导管活塞关闭,往启普发生器球形漏斗中注满水,静置一段时间后,观察到水面不下降,则说明气密性良好。
如气体实验的装置较多,也可考虑用分段检查的方法、原理与上述相同。
例1.有实验装置图(见图7-3)
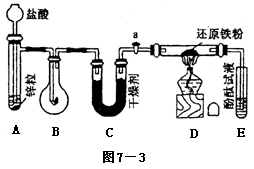
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U型管。a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,发生氢气。经必要的“操作”[见问题(2)]后,在导管出口处点燃氢气,然后如图所示套上烧瓶B,塞瓶塞,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性?______________。
(2)点燃氢气前必须进行___________操作,进行该操作的方法是___________。
(3)写出B、D中分别发生反应的化学方程式。
B中______________________________
D中______________________________
(4)C中所盛干燥剂的名称是_________;该干燥剂的作用是______________________。
8.常见事故的处理
①浓H2SO4溅到皮肤上,应用布拭去,再用水冲洗并涂上3~5%的NaHCO3。浓碱液溅到皮肤上,用水冲洗后涂抹硼酸溶液。
大量的酸液弄到桌上,要加适量的NaHCO3中和,然后用水冲洗,并用抹布擦净,大量碱液弄到桌上,要加适量的HAC中和。
不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛。
②苯酚的浓溶液沾到皮肤上,应立即用酒精冲洗。
③误服铜盐、汞盐等重金属盐,要立即喝豆浆、牛奶或鸡蛋清解毒。
④金属钠、钾起火,用沙子盖灭,不能用水、CO2灭火器、不能用CCl4灭火器。
⑤酒精灯不慎碰倒起火,要用沙子或湿抹布盖灭,不能用水泼灭。
⑥温度计不慎将水银球碰破,为防止汞蒸气中毒,应用硫粉履盖。
例2.某同学在实验报告中写有以下操作和实验数据,其中合理的是_________________(填编号)
①用托盘天平称取11.7g食盐
②用量筒取5.62mL某浓度的盐酸
③用pH试纸测得某溶液的pH值为3.5
④滴定某未知浓度的盐酸用去23.15mLNaOH标准溶液
⑤用500mL容量瓶配制250mL 0.1mol/L Na2SO4溶液
⑥用酸式滴定管量取25.00mL已知浓度的KMnO4溶液
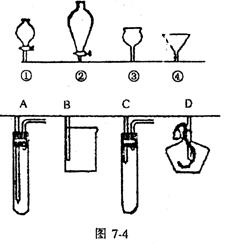
例3.如图7-4所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图。请指出A、B、C、D分别与①②③④相匹配的组合:A与__________;B与__________;C与_____________;D与______________。
例4.(1)某学生在中和滴定实验中用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的HCl溶液,其实验过程如下:
A.取一支酸式滴定管,用蒸馏水洗净,即加入已知物质的量浓度的NaOH溶液;B.调节好后记下液面刻度读数;C.用已润洗过的酸式滴定管精确放出一定量的待测酸液,置于未经待测酸液润洗的洁净锥形瓶中;D.加入酚酞试液2滴,摇匀;E.滴定时,边滴边摇匀,注视滴定管内液面变化;F.当小心滴到溶液由无色变成粉红色时,即停止滴定,并立即记下液面刻度读数;G.根据两次滴定消耗的NaOH溶液体积数的平均值进行计算。
指出上述实验过程中操作的错误之处____________(字母表示,多选要倒扣分)
(2)某学生准备用质量分37%,密度为1.19g·cm-3的浓盐酸配制0.10mol/L的稀盐酸500mL。
请回答下列问题
①量取浓盐酸的体积为______________mL,应选用量筒的规格为______________mL。
②配制时应选用容量瓶的规格为___________。
③配制时除容量瓶外,还需选用_____________、___________、____________和试剂瓶等仪器。
例题答案
例1.
(1)在A中放入少量水,使水面刚浸没漏斗颈下端,打开旋塞a,在烧瓶底部稍加热,若在A中漏斗颈内水面上升,且E导管口有气泡逸出,表示装置不漏气。(也可以关闭活塞口a,用同样的方法分别在烧瓶B底部和反应管D下部稍加热,检查活塞前、后两部分装置是否漏气。)
(2)用排水法(或向下排气法)收集一试管氢气,用拇指堵住,移近火焰,没有尖锐的爆鸣声,表示氢气是纯净的。
(3)B中:2H2+O2 ![]() 2H2O
2H2O
D中:N2+3H2 ![]() 2NH3
2NH3
(4)碱石灰(或生石灰、氢氧化钠固体)吸收气体中少量的水蒸气和盐酸酸雾。
例2.①④⑥
例3.A与③;B与②;C与①;D与④
例4.(1)A E F (2)①4.1,5 ②500mL 烧杯 胶头滴管 玻璃棒