北 京 四 中
年 级:高 三 科 目:化 学 编稿老师:潘廷宏
审稿老师:潘廷宏 责 编:广 毅 录 入:刘艳娥
高三化学实验检测题
一、选择题(每小题有1~2个选项符合题意)
1.下列有关实验操作的叙述中,不正确的是( )
A.少量的白磷贮存在水中,切割时在水下进行
B.制取硝基苯时,使用的温度计的水银球应浸没于反应混合液中
C.不慎将浓硫酸沾到皮肤上,应迅速用布拭去,再用水冲洗,最后涂上稀小苏打溶液
D.不能使用裂化汽油从溴水中萃取溴
2.下列实验操作中,仪器需插入液面下的有①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时,测量温度所用的温度计;④用乙醇制乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸
A.③⑤⑥ B.③⑤
C.①②④ D.①②③④⑤⑥
3.下列各实验现象能用同一原理解释的是( )
A.苯酚、乙烯都能使溴水褪色
B.稀硫酸中加入铜粉不反应,再加硝酸钠或硫酸铁后,铜粉溶解
C.葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀
D.将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,都产生白色沉淀
4.在化学实验室进行下列实验操作时,其操作或记录的数据正确的是( )
A.用托盘天平称取8.84g食盐
B.用250mL的容量瓶配制所需的220mL、0.1mol/L的NaOH溶液
C.用量筒量取12.12mL的盐酸
D.用0.12mol/L盐酸滴定未知浓度的NaOH溶液,消耗盐酸21.40mL
5.将淀粉溶液和淀粉酶的混合物放入玻璃纸袋中,扎好袋口,浸入流动的温水中,经相当一段时后,取袋内液体分别与碘水、新制Cu(OH)2悬浊液(加热)、浓硝酸(微热)作用,其现象依次是
| 试剂 | A | B | C | D |
| 碘水 | 显蓝色 | 显蓝色 | 无明显现象 | 无明显现象 |
| 新制Cu(OH)2(加热) | 无红色沉淀 | 红色沉淀 | 无红色沉淀 | 红色沉淀 |
| 浓硝酸(微热) | 显黄色 | 无明显现象 | 显黄色 | 无明显现象 |
6.某工厂排放的酸性废液里含有游离氯。Cl2可氧化Na2SO3,要除去游离氯并中和其酸性,正确的方法是
A.先加适量的Na2SO3溶液,再加适量Na2CO3溶液
B.先加适量的Na2CO3溶液,再加适量Na2SO3溶液
C.先加过量的Na2SO3溶液,再加适量Na2CO3溶液
D.先加过量的Na2CO3溶液,再加适量Na2SO3溶液
7.有以下四组物质:
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②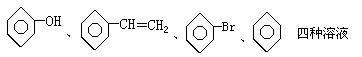
③MnO2、FeS、CuO、C四种黑色固体
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液。其中只用一种试剂(允许加热)就能将组内物质区别开的是( )
A.只有①③ B.只有①②③
C.只有①③④ D.全部
8.有一瓶无色气体,可能含有H2S、CO2、HCl、HBr、SO2中的若干种,将其通入氯水中,得无色透明液,将此溶液分成两份,向其中一份加入盐酸酸化的BaCl2溶液有白色沉淀;向另一份中加入HNO3酸化的AgNO3溶液有白色沉淀产生,则下列结论正确的是( )
A.肯定有CO2和SO2 B.可能有HBr、CO2
C.肯定没有HBr、H2S、HCl D.以上结论均不正确
9.实验室保存下列试剂采取的措施不正确的是( )
A.KI保存在棕色试剂瓶中
B.波尔多液盛放在铁制容器中
C.氢氟酸保存在塑料瓶中
D.溴水盛放在带胶塞的棕色瓶中
10.下列各组物质中,制备装置、收集装置均相同,且都可用浓H2SO4干燥的是( )
A.SO2和H2S B.CH4和NH3
C.CO2和H2 D.CH4和O2
11.都能用4mol/L NaOH溶液进行喷泉实验的一组气体是
A.HCl和CO2 B.NH3和CH4
C.SO2和CO D.NO和HBr
12.下列实验能成功的是( )
A.用食盐、MnO2和浓H2SO4共热制Cl2
B.将白P放在敞口试管内加热,冷却得红P
C.足量Cl2通入FeCl2 溶液后,将溶液蒸干得到FeCl3
D.将Cu丝伸入热的硫蒸气中得到CuS
13.下列有关实验所选用的试剂能达到目的是( )
A.证明NaHCO3溶液中混有苏打用澄清石灰水
B.证明SO2中混有CO2用澄清石灰水
C.证明AgNO3溶液中混有Al(NO3)3用氨水
D.除掉C2H6中的C2H4用酸性KMnO4溶液
14.为了除去酸性AlCl3溶液中的Cu2+,下列实验步骤顺序和试剂都正确的是( )
①通CO2 ②加盐酸 ③加过量NaOH溶液 ④加AlCl3溶液 ⑤过滤
15.下列各组物质中,只用水不能鉴别开来的是( )
A.无水硫酸铜,碳酸钠、硫化铝三种白色粉末
B.甲醇、乙醇和苯三种液体
C.甲苯、乙醇、CCl4三种液体
D.NaOH、NaCl、NH4NO3三种固体
16.不用其它试剂,就能将下列溶液一一鉴别开来的是( )
A.NaOH、NaHCO3、NaHSO4、AlCl3
B.NOH、NH4NO3、HC、KNO3
C.NaSO4、Ca(NO3)2、BaCl2、Na2CO3
D.CuSO4、KMnO4、FeCl3、溴水
17.有以下七种饱和溶液(1)Ba(NO3)2 (2)Ca(OH)2 (3)Na2SiO3 (4)CaCl2 (5)Na2CO3 (6)NaAlO2 (7)NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是( )
A.③④⑥ B.①③⑥ C.③⑤⑥⑦ D.③⑥
18.把稀HCl不断滴加入Fe(NO3)2溶液中的现象是( )
A.绿色变浅 B.绿色变深
C.绿色变棕黄 D.浅黄色加深
19.某种混合气体可能含有N2、HCl、CO依次通入足量NaHCO3溶液和灼热CuO,气体的体积都没有变化,再通过足量Na2O2固体,气体体积减小,最后通过灼热的Cu,充分反应,气体体积又减少,但还有剩余气体,以下对混合气体组分判断正确的是( )
A.一定没有N2,CO和HCl至少有1种
B.一定有N2,HCl和CO
C.一定有N2,CO和HCl至少有1种
D.一定有N2和CO,没有HCl
二、填空题
20.下图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入液体或固体试剂。请选择适宜装置的序号填于空白处。
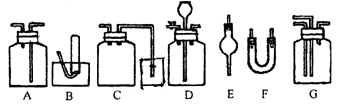
(1)既能用于收集Cl2,又能用于收集NO的装置是_________;
(2)能用作干燥CO2气流的装置是____________;
(3)在实验室制取Cl2并检验Cl2性质的连续实验中,用于除去C2中的HCl杂质的最佳装置是________;
(4)合成氨实验中,可用于干燥、混合并能大致观察H2和N2的体积比的装置是___________;
(5)用于尾气吸收并能防止液体倒吸到反应装置中的是______________;
(6)接在气体的连续实验中间,用于达到控制气流使其平稳目的的装置是________________。
21.下图所示是课外活动小组同学设计的几种尾气吸收装置(装置中的液体为水,固体为碱石灰)。从实验安全和保护环境的角度考虑,当用于吸收HCl气体时,应选用的装置是(选填装置序号)________________。若用于吸收NH3,在上述已选用的装置中不宜采用的是___________,原因是_________。
22.为探究苯与溴的取代反应,甲用右图装置I进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5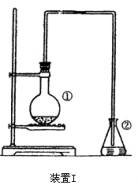 分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为_______________________________________。
②中离子方程式为_______________________________________。
(2)①中长导管的作用是____________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是____________________,要想得到纯净的产物,可用_________试剂洗涤。洗涤分离粗产品应使用的最主要仪器是_______________。检验产物已纯净的方法是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管口逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物。
产生红棕色气体的原因是___________________________________。
该红棕色气体会干扰反应产物的验证,请说明干扰的原因并用相关的化学方程式表示:__________________。
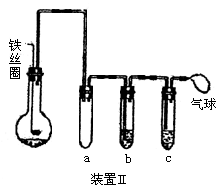 (5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
(5)乙同学设计右图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_____________________________。
b中的试剂是___________________________。
比较两套装置,装置Ⅱ的主要优点是________________。
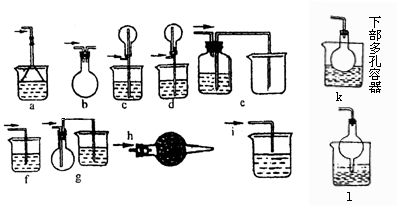
23.某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。
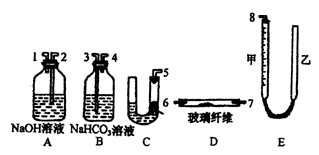
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水
试回答:(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):___________。
(2)装置C中放入的反应物是__________和__________。
(3)装置A的作用是__________,装置B的作用是__________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意____________和____________(填写字母编号)。
a.视线与凹液面最低数相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙管液面相平
24.用如图所示装置进行实验,将A逐滴加入B中。
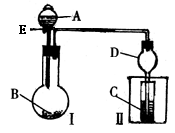
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是_______,然后往烧杯中加入沸水,又可观察到的现象是________。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A的酸性比_______强,然后往烧杯中加入沸水,又可观察到的现象是_________。
(3)若B是生石灰,实验中观察到C溶液中先形成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入沸水,静置片刻,观察到试管壁上出现光亮银镜。则A是__________,C是__________与葡萄糖的混合液。仪器D在此实验中的作用是_____________。
25.现有药品W克(W<1)锌片,稀H2SO4无水硫酸铜、氧化铜和水,请从下图中选用适当实验装置,设计一个最简单的实验,粗略测定锌原子量。(假设环境为标准状况)
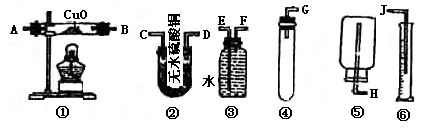
(1)应选用的装置是_______________________________________
(2)所用装置的连接顺序是(填接口字母)________________________________________
(3)操作中,怎样加放试剂以保证不漏出氢_________________________________________
(4)用实验所测的数据,写出计算锌的原子量的数学式。
答案:(解析见下周)
一、1.(B、D) 2.(C) 3.(B、C) 4.(D) 5.(C) 6.(C) 7.(D) 8.(D)
9.(B、D) 10.(C、D) 11.(A) 12.(A) 13.(C) 14.(B) 15.(B)
16.(A、D) 17.(C) 18.(C) 19.(C)
二、20.(1)A、B (2)A、E、F (3)A (4)G (5)C、E (6)D
21.吸收HCl用:a d e h i k l
吸收NH3不宜采用:h i,因为h中盛有碱石灰与NH3不反应;NH3比空气轻,在导管口处向空气中扩散,所以不用i。
22.(1)![]() ;Ag++Br-=AgBr↓
;Ag++Br-=AgBr↓
(2)导气,冷凝回流 (3)![]() 、Br2,稀NaOH溶液,蒸馏水。分液漏斗。取少量最后一次洗液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净。(4)该反应是放热反应,反应物和白粉加入的量不适当,会使液溴挥发。挥发的液溴溶于水,生成HBr,与AgNO3反应生成AgBr沉淀,因而无法确定HBr是否
、Br2,稀NaOH溶液,蒸馏水。分液漏斗。取少量最后一次洗液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净。(4)该反应是放热反应,反应物和白粉加入的量不适当,会使液溴挥发。挥发的液溴溶于水,生成HBr,与AgNO3反应生成AgBr沉淀,因而无法确定HBr是否![]() 与Br2取代反应的产物。Br2+H2O=HBr+HBrO
HBr+AgNO3=AgBr↓+HNO3 (5)a是安全瓶,防止倒吸,b中度剂是苯或四氯化碳。装置Ⅱ的优点①控制反应进行 ②防止倒吸 ③排除液溴的干扰 ④防止有害气体污染环境
与Br2取代反应的产物。Br2+H2O=HBr+HBrO
HBr+AgNO3=AgBr↓+HNO3 (5)a是安全瓶,防止倒吸,b中度剂是苯或四氯化碳。装置Ⅱ的优点①控制反应进行 ②防止倒吸 ③排除液溴的干扰 ④防止有害气体污染环境
23.(1)5、3、4、6、7(或7、6)2、1、8
(2)盐酸 大理石 (3)除去CO2,除去HCl气体 (4)a、c
24.(1)B是Mg,溶液又变红色 (2)H2CO3,溶液又变澄清 (3)A是浓氨水或浓铵盐,C是AgNO3,D的作用是防止倒吸
25.(1)④③⑥ (2)G接F E接J
(3)先向试管中加入一定量的稀H2SO4,(能没过锌片),将试管倾斜,小心地将锌片贴在试管壁上,塞好胶塞,连好装置,再将试管直立,使锌与稀H2SO4反应。
(4)设收集H2 VmL(标准状况),Zn的原子量为x
H2SO4+Zn=ZnSO4+H2↑
x 22.4L
W V×10-3L
x= ![]()
实验检测题解析
一、
1.D.裂化汽油主要成份是含有不饱和烃的混合物,与Br2水发生加成反应。直馏汽油主要成份是含有饱和烃的混合物,可以做萃取剂。
2.A:苯酚和Br2水发生取代反应,乙烯和Br2水发生加成反应 B:加入NaNO3后,引入NO3-,NO3-在酸性条件下有强氧化性,与Cu发生氧化还原反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
Fe3+与Cu发生氧化还原反应2Fe3++Cu=2Fe2++Cu2+
C:葡萄糖和福尔马林与新制的Cu(OH)2共加,都是-CHO被氧化成-COOH
D:加入HNO3,将SO2氧化成SO42-,SO42-与Ba2+生成BaSO4沉淀,其反应为
3SO2+2H2O+2NO3-=3SO42-+2NO↑+4H+
Ba2++SO42-=BaSO4↓
加入NaOH溶液,与SO2反应生成SO32-,SO32-与Ba2+生成BaSO3沉淀,其反应为:SO2+2OH-=SO32-+H2O
SO32-+Ba2+=BaSO3↓。前者是先发生氧化还原反应,后发生复分解反应,后者是先后都发生复分解反应。
4.A.托盘天平精确度为0.1g。
C.量筒精确度为0.1mL(纠正:B是正确的答案,答案为B、D)
5.淀粉在淀粉酶催化作用下发生水解,生成葡萄糖,渗出半透膜,淀粉酶是胶体仍在袋内。
6.反应的离子方程式为:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ 2H++CO32-=H2O+CO2↑
7.①用NaOH溶液 ②用Br2水 ③用浓HCl ④用Na2CO3
AlCl3与Na2CO3反应离子方程式:
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
8.气体通入Cl2水中,得无色透明溶液,说明无HBr;份加入HCl酸化的BaCl2溶液产生白色沉淀,说明一定含SO2,其发生的反应为:SO2+Cl2+H2O=SO42-+2Cl-+4H+,有SO2则无H2S,因二者发生反应:2H2S+SO2=3S↓+2H2O,另一份加HNO3酸化的AgNO3溶液产生白色沉淀,说明含Cl-,但Cl-可能是来自于Cl2水,原混合气体中是否含HCl不一定。所以原混合气体中一定含有SO2,一定没有H2S、HBr,可能含有HCl、CO2。
12.C.加热可以促进FeCl3水解,蒸干后HCl挥发出去,得到Fe(OH)3
FeCl3+3H2O
![]() Fe(OH)3↓+3HCl↑若再灼烧,则产物为Fe2O3 2Fe(OH)3
Fe(OH)3↓+3HCl↑若再灼烧,则产物为Fe2O3 2Fe(OH)3 ![]() Fe2O3+3H2O
Fe2O3+3H2O
13.A.用Ca(OH)2,与Na2CO3、NaHCO3都生成白色沉淀 B.SO2、CO2与Ca(OH)2都生成白色沉淀 C.NH3水滴入AgNO3中,先生成白色沉淀,继续滴加NH3水,沉淀又溶解,发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+ AgOH+2NH3·H2O=Ag(NH3)2++OH-+2H2O NH3水滴入AlCl3中,生成白色沉淀且不溶解。 D.C2H4被酸性KMnO4溶液氧化,最终产物是CO2,C2H6中混入了CO2。
15.A.加入水以后,无水CuSO4变蓝色,Al2S溶于水发生水解,生成白色沉淀和臭鸡蛋气味的气体,发生的反应为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑ B.甲醇和乙醇均溶于水,没有变化现象,苯与水混合,液体分层,上层为油状液体。 C.苯与水混合,液体分层,上层为油状液体(苯),乙醇溶于水,没有变化现象,四氯化碳与水混合,液体分层,下层是油状液体。 D.NaOH固体溶于水放热,温度升高,NH4NO3溶于水吸热温度降低,NaCl溶于水温度变化很小。
17.(1)(4)Ba(NO3)2和CaCl2与CO2都不反应,(2)最终生成Ca(HCO3)2溶液 (3)Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3 (5)Na2CO3+H2O+CO2=2NaHCO3 N NaHCO3溶解度比Na2CO3小,析出NaHCO3晶体 (6)NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 (7)NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
18.NO3-在酸性条件下有强氧化性,将Fe2+氧化成Fe3+,溶液由绿色变为棕黄色。
19.混合气体通过足量NaHCO3溶液和灼热CuO,气体体积都没有变化,可能含有HCl或CO。它们发生的反应为HCl+NaHCO3=NaCl+H2O+CO2↑
CO+CuO ![]() Cu+CO2。再通过足量Na2O2固体,气体体积减小,说明一定有CO2,从而推原混和气体中CO和HCl至少有一种。最后通过灼热的Cu,气体体积又减小,但还有剩余气体,说明有O2和Cu反应,最后剩余气体是N2。
Cu+CO2。再通过足量Na2O2固体,气体体积减小,说明一定有CO2,从而推原混和气体中CO和HCl至少有一种。最后通过灼热的Cu,气体体积又减小,但还有剩余气体,说明有O2和Cu反应,最后剩余气体是N2。
二、
20(1)NO只能用排水法收集,Cl2用排空气法收集,也可以用排饱和食盐水的方法收集用A装置时,要短管进气,长管出液体,即“短进长出”。
(2)干燥CO2气体用A装置盛浓H2SO4,用E、F装置分别盛碱石灰。
(3)用A装置盛饱和食盐水
(4)G装置盛浓H2SO4,将N2和H2分别由两个长导管通入浓H2SO4中,经混合后由短管排出。通过出气泡的个数来观察,控制H2和N2的体积比。
(5)在集气瓶中进气和出气的导管都比较短,当产生倒吸时,水流到集气瓶中而不会流到反应容器中。
(6)在广口瓶D中盛水,当进气量较多,速率较快时,长颈漏斗管中水位上升,气流速率减慢;当进气量较少,速率较慢时,长颈漏斗管中水位下降,气流速率加快。
22.(3)检验产物是否洗净,一般是取少量上层洗液进行检验,而不是取产物直接检验。
23.该实验目的是:制取O2并量取O2的体积,实验原理:用潮湿CO2与Na2O2反应制O2,再由排水量气法测量O2的体积。
干扰因素:①该题要求用潮湿CO2与Na2O2反应制O2,在凹形管中CaCO3与HCl反应生成的CO2中混有HCl气体,因此在气体进到盛有Na2O2的D装置之前,要用NaHCO3除去HCl ②影响测量O2准确度的因素有两点,一是CO2气体进入量气管,二是读数时量气管两边液面不平。因此在气体通到量气管之前通入NaOH溶液中除去CO2,读数时将量气管两边液面调平。
答案:(解析见下周)
一、1.(B、D) 2.(C) 3.(B、C) 4.(B、D) 5.(C) 6.(C) 7.(D) 8.(D) 9.(B、D) 10.(C、D) 11.(A) 12.(A) 13.(C) 14.(B) 15.(B) 16.(A、D) 17.(C) 18.(C) 19.(C)
二、20.(1)A、B (2)A、E、F (3)A (4)G (5)C、E (6)D
21.吸收HCl用:a、d、e、h、i、k、l
吸收NH3不宜采用h、i因为h中盛有碱石灰与NH3不反应;NH3比空气轻,在导管口处向空气中扩散,所以不用i。
22.(1)![]() ;Ag++Br-=AgBr↓(2)导管,冷凝回流 (3)
;Ag++Br-=AgBr↓(2)导管,冷凝回流 (3)![]() 、Br2。稀NaOH溶液,蒸馏水;分液漏斗。取少量最后一次洗液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净。(4)该反应是放热反应,反应物和Fe粉加入的量不适当,会使液溴挥发。挥发的液溴溶于水,生成HBr,与AgNO3反应生成AgBr沉淀,因而无法确定HBr是否
、Br2。稀NaOH溶液,蒸馏水;分液漏斗。取少量最后一次洗液,加入稀HNO3,再加入AgNO3溶液,溶液不浑浊说明产品已洗净。(4)该反应是放热反应,反应物和Fe粉加入的量不适当,会使液溴挥发。挥发的液溴溶于水,生成HBr,与AgNO3反应生成AgBr沉淀,因而无法确定HBr是否![]() 与Br2取代反应的产物。Br2+H2O=HBr+HBrO HBr+AgNO3=AgBr↓+HNO3 (5)a是安全瓶,防止倒吸,b中试剂是苯或四氯化碳。装置Ⅱ的优点①控制反应进行,②防止倒吸 ③排除液溴的干扰 ④防止有害气体污染环境。
与Br2取代反应的产物。Br2+H2O=HBr+HBrO HBr+AgNO3=AgBr↓+HNO3 (5)a是安全瓶,防止倒吸,b中试剂是苯或四氯化碳。装置Ⅱ的优点①控制反应进行,②防止倒吸 ③排除液溴的干扰 ④防止有害气体污染环境。
23.(1)5、3、4、6、7(或7、6)2、1、8
(2)盐酸、大理石 (3)除去CO2,除去HCl气体 (4)a、c
24.(1)B是Mg,溶液又变红色 (2)H2CO3,溶液又变澄清 (3)A是浓氨水或浓铵盐,C是AgNO3,D的作用是防止倒吸。
25.(1)④③⑥ (2)G接F,E接J
(3)先向试管中加入一定量的稀H2SO4(能没过锌片),将试管倾斜,小心地将锌片贴在试管壁上,塞好胶塞,连好装置,内将试管直立,使锌与稀H2SO4反应。
(4)设收集H2 VmL(标准状况),Zn的原子量为x
H2SO4+Zn=ZnSO4+H2↑
x 22.4L
w V×10-3L
x= ![]()